La velocidad de una reacción química depende de varios factores que a continuación describiremos.
Naturaleza de los reactivos
Concentración de los reactivos
Temperatura
Presencia del catalizador
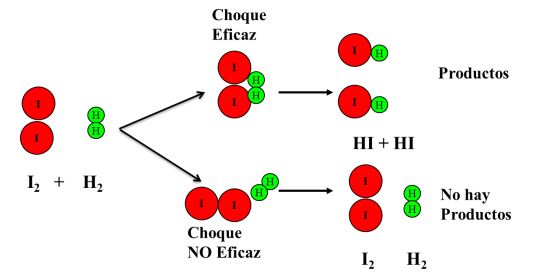
La naturaleza de los reactivos tiene que ver con situaciones como su estado de agregación. Cuando están en fase líquida o gaseosa reaccionan más de prisa y eficientemente ya que sus moléculas tienen más libertad de movimiento y esto ayuda a las colisiones eficientes. Si se trata de sólidos, conviene que estos estén finamente divididos para aumentar su área de contacto.
Concentración de reactivos: Al aumentar la concentración de los reactivos aumenta también significativamente la cantidad de colisiones efectivas en el mismo volumen. Esto hace que se favorezca la velocidad de toda reacción química.
Temperatura: El aumento de temperatura aumenta la energía cinética de las moléculas favoreciendo la cantidad de choques efectivos.
Catalizadores: Los catalizadores son claves para poder aumentar la velocidad de una reacción. En algunos casos ni siquiera se producen en ausencia de estos. Otra cualidad que tienen los catalizadores es que no participan en la reacción química, permaneciendo inalterados al final de esta y pudiendo servir para más reacciones. Los catalizadores disminuyen la energía de activación que es la energía mínima que se necesita para que se produzca cualquier reacción química.
Existen muchos catalizadores en la industria. Como ejemplo citaremos a algunos.
El Fe+3 cataliza la reacción de síntesis de amoníaco a partir del nitrógeno e hidrógeno.
El Paladio se usa en catalizadores de automóviles para atenuar la emanación de gases tóxicos.

Todos los articulos de quimica y fisuca son apasionantes e interesantes. Gracias.
Gracias a vos Jimmy. Cuando gustes te esperamos.