SOLUCIONES QUÍMICAS:
Las soluciones son sistemas homogéneos formados básicamente por dos componentes. Solvente y Soluto. El segundo se encuentra en menor proporción. La masa total de la solución es la suma de la masa de soluto mas la masa de solvente.
Las soluciones químicas pueden tener cualquier estado físico. Las más comunes son las líquidas, en donde el soluto es un sólido agregado al solvente líquido. Generalmente agua en la mayoría de los ejemplos. También hay soluciones gaseosas, o de gases en líquidos, como el oxígeno en agua. Las aleaciones son un ejemplo de soluciones de sólidos en sólidos.
La capacidad que tiene un soluto de disolverse en un solvente depende mucho de la temperatura y de las propiedades químicas de ambos. Por ejemplo, los solventes polares como el agua y el alcohol, están preparados para disolver a solutos iónicos como la mayoría de los compuestos inorgánicos, sales, óxidos, hidróxidos. Pero no disolverán a sustancias como el aceite. Pero este si podrá disolverse en otros solventes como los solventes orgánicos no polares.
CONCENTRACION:
La concentración es la relación que existe entre la cantidad de soluto y la cantidad de solución o de solvente. Esta relación se puede expresar de muchas formas distintas. Una de ellas se refiere a los porcentajes.
Porcentaje masa en masa o peso en peso, (%m/m):Es la cantidad en gramos de soluto por cada 100 gramos de solución. Ej: Una solución 12% m/m tiene 12 gramos de soluto en 100 gramos de solución.
Como formula, podemos expresar esta relación así:
%m/m = x 100
Porcentaje masa en volumen (%m/v): Es la cantidad en gramos de soluto por cada 100 ml de solución. Aquí como se observa se combina el volumen y la masa. Ej: Una solución que es 8% m/v tiene 8 gramos de soluto en 100 ml de solución.
Fórmula: % m/v = x 100
Porcentaje volumen en volumen (%v/v): Es la cantidad de mililitros o centímetros cúbicos que hay en 100 mililitros o centímetros cúbicos de solución. Ej: Una solución 16% v/v tiene 16 ml de soluto por 100 ml de solución.
Fórmula: % v/v = x 100
Otras formas son la Molaridad, la Normalidad y la Molalidad.
Es bueno recordad antes el concepto de mol. El mol de una sustancia es el peso molecular de esa sustancia expresada en gramos. Estos datos se obtienen de la tabla periódica de los elementos.
Sumando las masas de los elementos se obtiene la masa de la sustancia en cuestión.
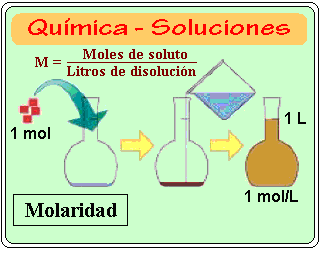
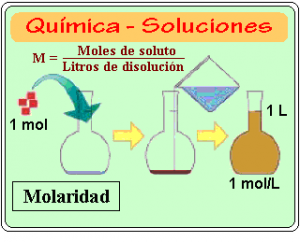
Molaridad: Es la cantidad de moles de soluto por cada litro de solución. Como fórmula:
M = n/V
M = M: Molaridad. n: Número de moles de soluto. V: Volumen de solución expresado en litros.
Normalidad: Es la cantidad de equivalentes químicos de soluto por cada litro de solución. Como fórmula:
N = n eq/V
N = Normalidad. n eq. : Número de equivalentes del soluto. V: Volumen de la solución en litros.
Molalidad: Es la cantidad de moles de soluto por cada 1000 gramos de solvente. En fórmula:
m = n/kgs solvente
m = Molalidad. n: Número de moles de soluto por Kg = 1000 gramos de solvente o 1 kg de solvente.
Antes de continuar con los ejercicios te recomiendo que mires los siguientes videos para que entiendas como resolverlos.
Ejercicios:
A continuación comenzaremos una guía de problemas donde pondremos en práctica a todas estas fórmulas.
1) Calcula el % m/m de una solución que tiene 6 gramos de soluto en 80 gramos de solución.
Aplicamos la fórmula:
% m/m = 6 grs x 100 / 80 grs
% m/m = 7.5
2) Calcula el % m/m de una solución que tiene 10 grs. de soluto y 110 grs. de solvente.
En este caso, la masa de la solución es de 120 grs. ya que resulta de sumar los 10 grs. de soluto mas los 110 grs. de solvente.
% m/m = 10 grs x 100 / 120 grs
% m/m = 8.33.
3) Calcula la masa de soluto que tendría una solución de 220 grs. que es 4% m/m.
En este caso podemos despejar la masa de soluto de la fórmula. Nos queda.
masa de soluto = % m/m x masa solución / 100
masa de soluto = 4% x 220 grs / 100
Masa de soluto = 8.8 grs.
4) Cuantos grs. de soluto y solvente tendrán 320 grs. de solución cuya concentración es 5 % m/m:
masa de soluto = 5 % x 320 grs / 100
Masa de soluto = 16 grs.
La masa de solvente es fácil obtenerla. Directamente le restamos a la masa de la solución la masa de soluto.
Masa de solvente = 320 grs. – 16 grs.
Masa de solvente = 304 grs.
5) Cuantos gramos de soluto tendrán 1200 ml de solución cuya concentración es de 6% m/v.
De la fórmula:
% m/v = masa de soluto x 100 / volúmen de sción
despejamos la masa de soluto.
masa de soluto = % m/V x volúmen de sción / 100
masa de soluto = 6 % m/v x 1200 ml / 100
V = 80 grs x 100 / (5 % m/v sción)
Masa de soluto = 72 grs.
6) Que volumen tendrá una solución al 5% m/v que contiene 80 grs. de soluto.
De la misma fórmula utilizada en el anterior problema despejamos el volumen.
V = ( masa de soluto x 100) / ( % m/v sción)
V = 1600 ml.
7) Cuál será el % v/v en una solución que se preparo con 9 ml de soluto y 180 ml de solvente.
El volumen de la solución lo obtenemos sumando a ambos volúmenes.
% v/v = ( volúmen de soluto x 100 ) / ( volúmen de sción )
% v/v = (9 ml / 189 ml) x 100
% v/v = 4.76.
8) Cuáles son los volúmenes del soluto y solvente de una solución de 2000 ml al 16 % v/v.
Volúmen de soluto = ( % v/v sción x Volúmen sción )
Volúmen de soluto = ( % v/v sción x Volúmen sción ) / 100
Volúmen de soluto = (16 % x 2000 ml) / 100
Volumen de soluto = 320 ml.
Volumen de solvente = 2000 ml – 320 ml.
Volumen de solvente = 1680 ml.
Densidad:
Con la densidad podemos transformar o pasar una cantidad de masa a su equivalente en volumen o viceversa.
Densidad = masa / volumen
Aquí les dejo 2 ejemplos.
1) Cuantos grs. habrán en un volumen de 12 ml de una solución que tiene una densidad de 1.84 gr/ml.
Masa = Densidad x Volumen
Masa = (1.84 gr./ml) x 12 ml.
Masa = 22.08 grs.
2) Que volumen tendrá una masa de 28 grs. de una solución cuya densidad es 1.76 gr./ml.
De la fórmula anterior despejamos al volumen.
V = masa / densidad
V = 28 grs / 1,76 grs/ml
V = 15.91 ml.
Molaridad:
Antes de continuar con problemas de Molaridad te invito a que mires este video así los entendes mejor.
1) Calcula la M de una solución que tiene 8 grs. de hidróxido de sodio (NaOH) en 680 ml de solución.
Según la fórmula de Molaridad.
M = n / V
Para calcular la Molaridad hay que saber la cantidad de moles y el volumen expresado en litros.
La cantidad de moles se calcula por
n = masa / ( Peso molecular )
n = 8 grs / 40 grs
n = 0.2 moles. Los 680 ml pasados a litros son 0,68 lts.
M = ( 0,2 moles ) / ( 0,68 lts )
Molaridad = 0.294 M (molar).
2) Cuantos moles de ácido clorhídrico (HCl) serán necesarios para hacer una solución 1,4M que tenga un volumen de 3.6 lts.
M = n / V
Despejamos n de la fórmula quedando:
n = M x V
n = 1,4 M x 3.6 lts.
n = 5.04 moles.
3) Que volumen tendrá una solución que es 2 M y contiene 18 grs. de hidróxido de potasio. (KOH).
El volumen lo despejamos de la fórmula de molaridad. Y los 18 grs. de soluto lo pasamos a moles.
M = n/V v = n/M
n = masa/PM n = = 0.321 moles.
V = ( 0,321 moles ) / 2 M
V = 0.16 lts.
4) Como prepararía 2 lts. de una solución 0,5 M de hidróxido de sodio (NaOH) a partir de otra, también de hidróxido de sodio, cuya concentración es 1.8 M.
Cuando se prepara una solución a partir de otra de mayor concentración lo que se hace es tomar una cantidad de la de mayor concentración y luego se la diluye con agua hasta llegar al volumen requerido de la de menor concentración. Para saber cuánto debemos tomar de la más concentrada usamos la siguiente fórmula.
M1 x V1 = M2 x V2
Los subíndices numéricos se usan para diferenciar a las dos soluciones de distinta concentración. Llamamos 1 a la más concentrada y 2 a la más diluida.
1.8 M x V1 = 0.5 M x 2 lts.
V1 = ( 0,5 M x 2 lts ) / ( 1,8 M )
V1 = 0.555 lts.
Se toman 0.555 lts de la solución más concentrada o 555 ml y se disuelven hasta 2 litros.
5) Calcula la M de una solución de ácido sulfúrico (H2SO4) de densidad 1.82 gr/ml y de 94% de pureza.
Sabemos que para calcular la molaridad tenemos que tener los datos de la cantidad de moles y el volumen expresado en litros.
A partir de la densidad deducimos que en un ml de solución hay 1.82 grs. de masa de solución. Por lo tanto en 1 litro habrá 1820 gramos de solución. Ahora bien, de esos 1820 gramos solo el 94% es puro en el soluto que tenemos. Con un simple cálculo de porcentaje obtendremos la cantidad que realmente hay de soluto en esos 1820 gramos.
1820 grs. x 0.94 = 1710.80 grs.
A partir de esta masa sacamos la cantidad de moles.
n = ( 1710,80 grs ) / ( 98 grs/mol )
n = 17.457 moles.
Estos cálculos se basaron al principio cuando usamos la densidad en un volumen de 1 litro. Por lo tanto si dividimos esta cantidad de moles por un litro obtenemos directamente la molaridad.
Molaridad = 17.457 M (molar).
6) Se dispone de un ácido nítrico comercial del 96,73% en peso y 1,5 gr/ml densidad ¿Cuántos ml de ácido concentrado serán necesarios para preparar 0,2 litros de disolución 1,5 molar de dicho ácido?
Directamente lo podemos hacer cambiando las unidades con los factores de conversión hasta llegar a molaridad. Se van cancelando las unidades viejas y quedan solo las nuevas, es decir mol/litro que es M (molaridad):
Primero usaremos el porcentaje de pureza, luego la densidad, los mililitros a litros y por último pasaremos la masa a moles.
(96,73 grs soluto / 100 grs solución) x (1,5 grs soluc / 1 ml soluc) x (1000 ml soluc / 1 litro) x (1 mol acido nítrico / 63 grs soluto) = 23 M
Ahora con la fórmula M1 x V1 = M2 x V2 calculamos el volumen del ácido concentrado que necesitarás. Podes llamar con el 1 a la solución concentrada y con el 2 a la nueva solución.
V1 = M2 x V2 / M1 = 1.5 M x 0,2 lit / 23 M = 0.013 lit = 13 ml
Entonces tomas 13 ml de la solución concentrada y le agregas agua hasta que llegues a los 200 ml o 0,2 litros que nos piden.
7) Cuál será la Normalidad de una solución de ácido clorhídrico que tiene 6 grs. de este en 1200 ml de volumen.
A partir de la fórmula:
N = N° de equivalentes de soluto / V (scion en lts)
Tenemos que calcular el número de equivalentes de soluto y pasar a litros el volumen que ya tenemos de solución.
En el caso de los ácidos el número de equivalentes se calcula dividiendo la masa de este por el peso del equivalente químico de este. El equivalente químico en el caso de los ácidos se calcula dividiendo el peso molecular por la cantidad de hidrógenos que tiene la molécula. El ácido clorhídrico tiene un peso molecular de 36.5. Tiene un solo átomo de hidrógeno, por lo tanto su peso equivalente es el mismo.
N de eq soluto = ( 6 grs ) / ( 36,5 grs/eq )
N de eq. Soluto = 0.164 equivalentes.
Normalidad = (0,164 equiv) / ( 1,2 lts)
Normalidad = 0.137.
8) A un recipiente que contiene 200 mL de solución acuosa 0.2 M de H2SO4 se le agregan 10 mL de H2SO4 puro (densidad=1.83 g/mL). Suponiendo volúmenes aditivos, calcular para la solución resultante la normalidad.
Debemos calcular el número de moles totales y después el de equivalentes en este caso. Por ejemplo en la primera solución tenemos:
Moles = 0,200 lts x 0,2M = 0,04 moles.
Como el H2SO4 tiene 2 hidrógenos la cantidad de equivalentes es moles x 2 = 0,08 equivalentes.
Ahora calculamos los equivalentes de la otra solución. Pero de la otra no tenemos la Molaridad, por lo tanto la debemos calcular de la densidad y del % de pureza que es del 100% por ser puro.
M = 1,83 grs/ml x 1000 ml/litro x 1 mol/98 grs = 18.67 M (molar) por lo tanto tiene 18,67 M x 0,01 litros = 0,187 moles o sea, 0,374 equivalentes.
Si sumamos tenemos 0,08 equivalentes + 0,374 equivalentes = 0,454 equivalentes en total al mezclar ambas soluciones. Entonces N = equiv/litros. N = 0,454 equiv / 0,21 litros = 2.16 N de la solución final. El volúmen de 0,21 litros se obtuvo sumando los volúmenes aditivos.
9) Que volumen tendrá una solución 2.6 N de hidróxido de calcio ( Ca(OH)2 ) si la cantidad de soluto usada fue de 4 moles.
N = N° eq (st0) / V
Despejamos el volumen:
V = N° eq (st0) / N
En este caso tenemos moles pero no equivalentes. Se puede pasar de una manera sencilla de moles a equivalentes. Teniendo en cuenta que para calcular el peso de un equivalente de un hidróxido se divide al peso molecular por la cantidad de grupos oxhidrilos. El peso del equivalente es el peso molecular dividido por 2. Ya que este hidróxido posee 2 grupos oxhidrilos. El peso molecular es 40. Por lo tanto el peso del equivalente de Ca(OH)2 es 20. Deducimos por lo tanto que en un mol de este compuesto hay 2 equivalentes. Como tenemos 4 moles del hidróxido tenemos 8 equivalentes.
V = 8 eq / 2,6N
V = 3.077 litros.
10) Calcula la Normalidad de:
Una solución 4 M de NaOH.
Una solución 6 M de Mg (OH)2
Una solución 0.5 M de H2SO4
Una solución 0.8 M de HNO3
En el caso del NaOH vemos que tiene un solo radical oxhidrilo, o sea que el peso molecular o el mol coincide con el peso de un equivalente químico. Por lo tanto si es 4 M también será 4 N.
En el segundo caso, el Mg(OH)2, tiene 2 grupos oxhidrilos. El peso de un equivalente será la mitad del peso molecular. En un mol hay dos equivalentes. Entonces si es 6 M será 12 N.
En el tercer caso, vemos que el ácido sulfúrico tiene 2 hidrógenos. O sea que el peso de su equivalente será la mitad de su mol o peso molecular. En un mol hay dos equivalentes. Asi que si es 0.5 M será 1 N.
En el último caso, este ácido (ácido nítrico), tiene un solo hidrógeno. Asi que un mol equivale a un equivalente. Es igual su molaridad y su normalidad. Es 0.8 M y 0.8 N.
Antes de continuar con molalidad no te pierdas este tutorial en el cual te explico 2 ejercicios modelo de molalidad.
11) Calcula la molalidad de una solución que se prepara con 16 gramos de Hidróxido de Potasio (KOH) y 1600 gramos de agua.
La fórmula es:
m = Moles (st0) / Kg svte
Tenemos que transformar los 16 grs. del soluto a moles.
n = (16 grs) / (56 grs / mol)
n = 0.286 moles.
Esta cantidad de moles está presente en 1600 gramos de agua. Por lo tanto en 1 kg de agua habrá.
m = (0,286 moles) / (1,6 Kgs)
0,179 m (molal).
12) Cuantos gramos de soluto habrá en una solución 2.8 m de Li(OH), que se hizo con 500 ml de agua.
En el caso del agua 1 gramo equivale a un ml. Por lo tanto aceptamos que 500 ml son 500 grs.
Primero calcularemos la cantidad de moles de soluto. Despejando de la fórmula:
m = n / kgs svte
n = m x kg de svte.
n = 2.8m x 0,5 kgs.
n = 1.4 moles.
Ahora el último paso es pasar esta cantidad de moles a gramos.
La masa es igual al peso molecular por la cantidad de moles.
Masa = 23.94 grs./mol x 1.4 moles.
Masa = 33.52 gramos.
13) Calcula la masa de agua que se utilizó para preparar una solución 2,2 m si se utilizó 12 gramos de soluto (NaOH).
Primero hay que saber la cantidad de moles de soluto. El peso molecular de NaOH es de 40.
moles = 12 grs / (40 grs/mol)
0.3 moles. Luego de la fórmula de m:
m = moles/kgs svte Kg svte = moles sto / m
Kgs de solvente = 0,3 moles / 2,2 m
0.136 kilos o 136 gramos de agua.
14) Calcula la M y N de una solución que se preparó con 28 gramos de Mg(OH)2 al 82 % de pureza en un volumen final de 1600 ml.
Primero debemos corregir la masa de 28 gramos ya que al no ser 100% pura en realidad no hay 28 gramos sino que habrá algo menos.
28grs. x 0.82 = 22.96 gramos.
Estos gramos ahora lo pasaremos a moles.
Moles = 22,96 grs / (58,3 grs/mol)
Moles = 0.39 moles.
Molaridad = 0,39 moles / 1,6 lts
Molaridad = 0.24 M (molar).
Como este hidróxido tiene 2 radicales oxhidrilos. Por cada mol tenemos 2 equivalentes. Por lo tanto será 0.48 N (Normal).
Espero que te haya sido de utilidad el artículo.
Bioquímico: Patricio Arroyo
1) Calcula el % v/v de una solución que tiene un volumen de 1400 ml y 980 ml de agua (solvente).
Rta: 30% v/v.
2) Que masa de AgOH se necesitara para preparar 3 litros de una solución 0,4 M en este soluto.
Rta: 148.8 grs.
3) Que densidad tendrá una solución de 1500 centímetros cúbicos y 1,9 kgs.
Rta: 1.267 grs./ml.
4) Cuál será el volumen de una solución que tiene 20 gramos de soluto y una concentración de 6% m/v
Rta: 333.33 ml.
5) Que masa de solvente se necesitará para hacer 260 grs. de una solución al 4% m/m
Rta: 249.6 grs.
6) Calcula la Normalidad de: HNO2 (2M) – KOH (0.4M) – H2SO3 (3M) – Al(OH)3 (1M) – Na3PO4 (0.6M) – NaCl (2M).
Rta: 2N – 0.4N – 6N – 3M – 1.8N – 2N.
7) Que volumen de solución ocuparan 3 equivalentes de soluto de una solución 4N.
Rta: 0.75 litros.
8) Que m (molalidad) tendrá una solución que se preparo colocando 20 gramos de NaOH en 2200 ml de agua.
Rta: 0.227 molal.
9) Como prepararía 2 litros de una solución 0.4 M a partir de otra que es 4 M.
Rta: Tomamos 200 ml de la más concentrada y la diluimos hasta llegar a 2 litros de volumen.
10) Que molaridad tendrá una solución que fue preparada añadiendo 46 grs. de Ca(OH)2 al 79 % de pureza a cierta cantidad de agua obteniendo un volumen final de 4200 ml.
Rta: 0.117M.
Otros artículos importantes
Densidad. Ejercicios resueltos
gracias.. me ha servido mucho todo lo que con refiere a quimica,estequimetria,compuestos y nomenclatura,ademas de soluciones, gracias por los apartes tan claros e hilustrados.. disssculpa por no agradesr en cada post que te leei es q ando estudiando para mis examenes y me has aclarado muchas dudas gracias
Hola Patricio ,con el mayor de los respeto ,quiero decirte muchas gracias por tu aporte muy valioso, me salvaste el parcial de química, no entendía nada de nada ,ahora estoy lista para rendir!!!! GRACIAAS MIL GRACIAS!!!
Gaby querida me llena de felicidad que estés mejor para rendir y contame como te fue.
muy buena somos dos
Me sirvió de mucha ayuda gracias 🥰
Me alegro.
en la primera parte de los ejercicios , te equivocaste en la pregunta 7 .Que en ves de poner 180 de solvente como decia en la pregunta del ejercicio colocaste 189
Hola, no me equivoque, hay que poner 189 ml porque ese es el volumen de la solución no del solvente. Fijate bien, es la suma de soluto con solvente o sea, 189 ml.
Hola me puedes ayudar plis
En que?
hola profesor, por favor me podrias mandar tu email para cualquier consulta y quisiera saber si das clases de quimica, gracias.
Hola César. [email protected] espero tus preguntas. Si claro que doy clases.
hola me puedes ayudar
No se equivoco, la cosa es que para hallar la solucion total se suma el STO mas el STE mas poder hallar el pocentaje en masa.
Me alegro. Después de mucho te contesto pero espero que te haya ido bien en todo Wilson.
hola
un excelente material de apoyo, eso si podrias especificar más desarrollando paso a paso lo que se necesita para llegar al resultado
jajajajaja no entiendo
Animooo
BUEN DIA, POR FAVOR ME PUEDES AYUDAR CON ESTO….
Una muestra de azufre amarillo en polvo es colocada dentro de un frasco sellado al cual se le ha extraído el aire y éste se ha reemplazado con un gas inerte. Se aplica calor por medio de una llama, hasta que el azufre hierve y empieza a ebullir. Al dejar enfriar, el material en el frasco es rojizo y tiene la consistencia de la goma de mascar. Un análisis químico cuidadoso demuestra que la sustancia es azufre puro. ¿Es éste un cambio físico o químico? Proponga una explicación para el cambio.
Entonces es un cambio físico porque la identidad química no sufrio variación
jajajajaja yo menos 😀
no entiendo lo que me quieren decir la pagina
muy interesnte tu aporte
me podrias ayudar con este problema
Cuantas moles hay en una solucion de H3PO4 que se prepare midiendo 10mililitros de acido en 1 litro de agua y con una densidad de 1.4
te lo agradeceria mucho
Hola Daniel. Bueno mira quisiera saber si la densidad es de la solución o del ácido?. Aparte creo que estaría faltando el porcentaje d epureza del ácido o no esta?. Abrazo
gracias me sirvió en todo porque muchas paginas que visite no me explicaron lo que yo quería siempre encontraba cualquier cosa pero bueno gracias
No entiendo muy bien lo de el soluto como hago¿
es muy facil mas facil imposible Vanessa
el primer ejercisio se encuentra erroneo , el dato de 6 gramos se debe sumar al dato de 80 para obtener el total de disolucion el de 6 gramos de divide por la suma de los anteriores y da un total de 6.97 porfabor corriga el dato
estas muy equivocado. Los 80 gramos ya son de solución. Tienen incluídos a los 6 gramos de soluto. Por favor lee bien primero el ejercicio.
Hola, Patricio. Me podrías ayudar
Cuántos gramos de ácido sulfúrico hay en 60 cm cúbicos de una disolución con concentración al 98% m/m Cuya densidad es 1.84grs/cm cúbicos.
Hola Alba. Entra acá y de paso conoces mi Canal de Quimicayalgomas
https://www.youtube.com/watch?v=goHomNQH34w
muy buen material pero no lo puedo copiar para guardarlo no se si me lo pueda mandar a mi correo para consultarlo cuando tenga necesidad soy estudiante de QFB se lo agradeceria mucho [email protected]
En el problema final el 12. Me sale el equilibrio del soluto que es 0.48 que es su resultado final, pero que no falta el dividirlo por el volumen para que salga el resultado correcto?
No se te entiende Daniel
gracias! me a servido de mucha ayuda! ahora si con fe a mi examen !
Me alegro éxitos
Gracias me ayuda para estudiar para febrero :_
De nada Viky para eso estamos. Ante cualquier duda escribinos
muy bueno y conciso tu apunte.
gracias
muy bueno y conciso tu apunte.
gracias
etooo xD
gracias, es lo que buscaba xD
sencillos y variados para practicar xD
un problema:en l compuesto xso4 ;el elemento «x»representa el 20% dela masa total . determinar el peso atomico de «x» gracis si lo puedenresolver
lo puedes hacer con una regla de tres. Si sumas los pesos de loa átomos de S y O te da 96. obviamente esto es el 80% ya que x es el 20%. Asi que X = 20 x 96 / 80
X = 24
¿cual es la normalidad de 40 gramos de LiOH en 250 ml?
Debes transformar los 40 gramos a equivalentes químicos. En el caso de los hidróxidos se divide el peso molecular por la cantidad de oxhidrilos. En este caso sería 24 grs/1 = 24 grs. Por lo tanto en 40 grs habrán 40/24 = 1,67 eq. Después la N = n eq / litros.
N = 1,67 eq/0,25 l
N = 6,68
El problema para Andrea del 20 de marzo tiene un error.
Se dividen los 40 g de LiOH entre su equivalente químico (24)=1.667 que luego se dividen entre el volumen en Litros /0,25 siendo el resultado final de 6,67 N
SUGIERO QUE CORRIJAN PARA NO CONFUNDIR A LOS MUCHOS VISITANTES, GRACIAS.
Oscar ya esta corregido. Te aclaro que es normal que hayan errores en sitios tan exitosos con un enorme caudal de visitantes. Y de esos sitios muy pocos se toman el trabajo de contestarles y resolver los problemas que piden los visitantes. Por lo tanto hay mas probabilidades de errores también. Si no contestaría ninguno nunca cometería errores pero los contesto. Aparte obviamente las equivocaciones son muy contadas. Te invito a ver los comentarios para que veas la conformidad de los visitantes con quimicayalgomas. Agradecido por la corrección.
BUENAS NOCHES; estuve viendo el problema de Andrea de Marzo del 2013 que pregunta sobre la Normalid de 40grde Na(oH) en 250ml . el equivalente quimico no es PM/OH ,EL pmDEL HIDROXIDO DE SODIO NO ES 40 y tiene 1 (OH) porque le da 24? .Es la duda que tengo ,me la podra salvar .Se lo voy agradecer
Necesito resolver este ejercicio que no me sale, por favor ayudenme:
Se dispone un ácido nítrico comercial del 96,73% en peso y 1,5 gr/ml densidad ¿Cuántos ml de ácido concentrado serán necesarios para preparar 0,2 litros dde disolución 1,5 molar de dicho ácido?
Espero me puedan responder, desde ya muchas gracias!!
Hola. Primero debes calcular la M de la solución comercial. Directamente lo podes hacer cambiando las unidades hasta llegar a molaridad. Aqui sera dificil explicarlo. Pero se trata de ir convirtiendo unidades. Se van cancelando las unidades viejas y quedan solo las nuevas, es decir mol/litro que es M (molaridad):
96,73 grs soluto / 100 grs solucion x 1,5 grs soluc / 1 ml soluc x 1000 ml soluc / 1 litro x 1 mol acido nítrico / 63 grs = 23 M
Ahora con la fórmula M1 x V1 = M2 x V2 calculas el volúmen del ácido concentrado que necesitarás. Podes llamar con el 1 a la solución concebtrada y con el 2 a la nueva solución.
V1 = M2 x V2 / M1 = 1.5 M x 0,2 lit / 23 M = 0.013 lit = 13 ml
Entonces tomas 13 ml de la solución concentrada y le agregas agua hasta que llegues a los 200 ml o 0,2 litros que te piden. En el sitio hay algunos problemas de este tipo para que los leas.
Si se quiere determinar la concentración de un hidróxido OH de una muestra, se toman 25,0ml de muestra se hacen reaccionar con 15ml de solución de HCL(ac) cuya concentración 12% m/v
2do Calcule la masa de NA2SO4 que se obtendrá si se parte 10,0ml de una solución al 10% m/v del ácido y 5,000g del hidróxido
No entiendo la primera pregunta. Llegan a la neutralización?. Esto hay q saber para aplicar el cálculo de neutralización.
Hola buenas tardes. necesito de su ayuda para resolver este ejercicio.
se tiene 450ml de una solucion acuosa de acido sulfurico (H2So4) de concentracion 2.36 mol/l. 36°c y su densidad 1.24gr/ml.. determinar
a) %m/v
b) Xsto y Xsvte
c) m
d) Pto de ebullicion
espero me puedan ayudar =). gracias.
Hola. Con los ejemplos que expuse lo podrás hacer. Primero calcula con la Molaridad y el volúmen en litros los moles. 2.36M x 0.45 lit = 1.062 moles. Estos los pasas a masa. Te da 104.08 gramos. Si en 450 ml tienes 104.08 grs se ácido en 100 ml tendrás: 23.13 % m/v. La X (fracción molar) lo calculas dividiendo los moles del ácido sobre los moles totales incluyendo al agua. Los moles del agua los calculas a partir de la densidad. Como densidad es masa / volumen d x V = masa. 558 gramos de solución. Ahora a esta cantidad le restas los gramos de soluto (ácido) y quedara la cantidad de agua. 558 grs – 104.08 grs = 453.92 grs. A moles de agua son: 25.22 moles. X soluto = 1.062 / (1.062 + 25.22) moles = 0.04. De la misma forma sacas la X solvente pero obviamente al reves o sea moles de agua sobre moles totales.
Para Pto de ebullición te recomiendo mires propiedades coligativas en otro de mis post.
Porfis porfis estoy muy preocupada, necesito responder esta pregunta para mañana y juro que e buscado en todas partes pero no sé la respuesta;
«Derive dos ecuaciones para pasar de %m/m a %m/v y a Molaridad»
Porfavor ayudeme, necesito esas ecuaciones :C
A esto se hace con los factores de conversion. Si te dan %m/m deberías multiplicarlo por la densidad y tendras % m/V. Ahora si te piden pasarlo a M deberías multiplicar al % m/m por la densidad x 10 y dividirlo por el peso molecular del soluto. O sea.
%m/m x d x 10 / PM
Esto sería la respuesta a la pregunta que te molesta. Tranquila no es tan grave
necesito dos procedimientos que expliquen las diferentes soluciones
Procedimiento para que?. Explicate mejor Daniela
cuales son la formulas de %m/m %v/v y de %m/v!!plis lo nesecito de inmediatooooo!!!!responde
en el post figuran todas
Hola tengo una consulta para hacerte, tengo que preparar 2L de acido azico a partir de NaCl 0,3M 0,05%m/v pm=58,5. No estoy segura si lo hice correctamente podras enunciarme los pasos. Gracias!!!
ácido azico? nunca lo escuche pasame la fórmula molecular. Aparte hacer ácido con NaCl no creo q puedas.Explicate mejor
Hola una pregunta, que sustancia actua como solvente en las soluciones acuosas?
El agua. El decir acuoso justamente viene de agua
DONDE DICE EL «EL PRIMERO ESTÁ EN MENOR PROPORCIÓN», SERÍA AL REVÉS, PORQUE EL QUE ESTA EN MAYOR PROPORCIÓN ES EL SOLVENTE, NO EL SOLUTO!!!!
Es cierto Mati ya lo corregi gracias. Antes estaba escrito soltuto y solvente peor no corregí lo que venía despues. Abrazo
¿Ayudame con una tarea ?
¿Cual?
Exelente informacio muchas gracias pero no explicaste detalladamente molalidad y normailidad espero y lo puedas explicar graciassss
que significa q una solucion tenga concentracion de 20%P/P?
Hola significa que tiene 20 gramos de soluto en 100 gramos de solución. Estos 100 gramos contienen a los 20 gramos de soluto.
Hola Pofavor Como preparo hidroxido de potasio a 2 Normal.gracias
Pesas 2 equivalentes gramo de hidróxido de potasio y lo diluís con agua destilada hasta un litro. El peso del equivalente de este soluto es el peso molecular de KOH dividido por 1 por tener un grupos OH (KOH). Daría unos 56 gramos pero pesamos 112 gramos por necesitar 2 equivalentes. Por sino quedo claro me vuelves apreguntar q duda te quedo.
podrías ayudarme con este problema por favor? te lo agradecería mucho:
QUE CANTIDAD SE NECESITA PARA PREPARAR UNA SOLUCIÓN 4 NORMAL SI SE TIENE UN VOLUMEN DE 25ML DE BICARBONATO DE CALCIO, SI TIENE UNA PUREZA DE 45% Y UNA DENSIDAD DE 1.25, CON VALENCIA 2
Primero sacamos el equivalente de sta sal. El equivalencte de esta sal se calcula dividiendo su peso moelcular por 2 ya que tiene dos cargas + o dos -. Nos da 81 gramos. Ahora debemos sacar la normalidad de la solución q tenemos. Para luego compararla con la de 4N.
45/100 x 1,25 grs/1ml x 1000 mol/1 litro x 1 eq/ 81 grs = 6.94N.
Ahora con la fórmula N1 x V1 = N2 x V2 sacamos V2 q pertenece a nuestra solución que le sacamos la N.
V2 = N1 x V1 / N2
V2 = 4N x 25 ml / 6.94N
V2 = 14,41 ml
Tomamos 14,41 mililitros de la segunda solución y lo diluimos hasta 25 mililitros con agua asi tenemos 25 ml de solución 4N.
Hola una consulta. Como se calcula la uma de una molécula y la de un átomo? Saludos
Hola la UMA tiene un valor constante. Es de 1,66×10^-24. Se calcula a partir del peso del átomo de Carbono 12 cuyo mol es de 12 grs. Entonces si en 12 grs representa el peso de 6,022×10^23 átomos, un átomo pesara: 1×12/6,022×10^23 y a este valor lo divides por 12 dando el número que coloque al principio y el que seguramente figura en el artículo. Ya que por definición es la doce ava parte de la masa del átomo de carbono 12
Gracias por los ejercicios de masa pero les diria que pongan mas me sirvieron de muha ayuda para repasar mi prueba gracias………………………………………..
hola me podrías ayudar con un problema que dice: 250 ml de solución de 1N de acido fosforico contienen ……….. mmoles de soluto tengo que averiguar los mili moles equivalentes . gracias desde ya
Hola. Según la fórmula N = equiv/litros scion. Si usamos mililitros obtendremos miliequivalentes. Entonces 1N x 250ml = 250 meq. Nose q duda mas tenes
hola me ayudarias con este ejercicio:
cuantos gr de MgO se obtienen cuando se hacen reaccionar 150 gr de Mg del 80% de pureza en presencia de oxigeno
3 Mg + O2 —- 2 MgO
gracias
Ante todo esta mal balanceada. son 2 de Mg no 3. 2 Mg + O2 —- 2 MgO Por lo tanto si tenes 150 grs de Mg no serán 150 si su pureza es del 80%. Entonces sera 150×0,8 = 120 grs los q reaccionan. Entonces si el PM de Mg es 24 aprox. Tenemos 48 grs producen 80 grs de óxido de Mg. Por lo tanto 120 grs de Mg producirán:
48 grs Mg —— 80 grs de MgO
120 grs de Mg —– X = 200 grs de MgO
buen día quisiera preguntar como resolvió este ejercicio
1) Calcula el % v/v de una solución que tiene un volumen de 1400 ml y 980 ml de agua
(solvente).
Es fácil. La fórmula es: %V/V = (V sto/V solvente) x 100
El volumen de solvente lo tenés es el agua. El volúmen de soluto lo sacas por diferencia. V sto = 1400 ml – 980 ml = 420 ml.
Por lo tanto: %V/V = (420 ml / 1400 ml) x 100 = 30% V/V Ahí en el post hay muchos ejercicios de ejemplos abrazo.
gracias, tengo otra inquietud como se resuelve el punto 10
GRACIAS.
q punto 10 a q te referis??
Que molaridad tendrá una solución que fue preparada añadiendo 46 grs. de Ca(OH)2 al 79 % de pureza a cierta cantidad de agua obteniendo un volumen final de 4200
Es fácil hace esto. Saca la masa de soluto real en base al % de pureza de esos grs obtenidos los pasas a moles y dividis por 4,2 litros esa es la molaridad
hola quisiera preguntarte como resuelvo este ejercicio:
se prepara una scion de H2SO4 disolviendo 0.015kg en un volumen final de 15 ml. calcular %p/p. como puedo hacerlo si me da en ml el volumen final?? no se supone q hablando de % peso/peso tendría que ser en gramos??
Claro debe ser en gramos pero la unica manera es si te dan la densidad. Si te dan la densidad ahí si puedes. Porque con la densidad podes pasar los ml a gramos ya que la densidad es de la solución como siempre. Verás en el post en los ejemplos que puse hay densidad para los casos como estos
ayudame kon este porfa
cuando 55.5 g. de cacl, se disuelven en 400g. h20,produce una solucion dedensidad 1.1g/ml encontrar
p.p
molalidad
p.p.m
fraccion molar
formalidad
moralidad
ay y como hago para resolver esa densidad como ahgo para saber cuantos g es la sdolucion
ay si eres formalisiimo me los resuelves o formulas ayudameee es la recuperaciom
Te contestare algunas porque es muy extenso lo que pedis. % P/P = (masa soluto/masa solucion) x 100 = 55,5 grs/455,5 grs x 100 = 12.21% P/P
ppm = 1000000 x 55,5/455,55 = 121830.75 ppm
para molaridad debes calcular el volumen de la solución y para eso usaras la densidad. V = masa/densidad. V = 455,55gr / 1,1 g/ml = 414.14 ml = 0,414 lts
los moles de soluto son 55.5/111 = 0,5 moles.
M = 0,5 moles/ 0,414 litros = 1,21 M
fraccion molar (X): Se calcula dividiendo los moles d esoluto sobre los moles totales. Hay q saber los moles de soluto y de solvente o sea del agua. Moles agua: 400 grs/ 18 (peso molecular) = 22.22 moles
X = 0,5 moles soluto / 22,72 moles = 0,022
Entra al post de estequiometría que tengo problemas de estos resueltos para eso los puse. Besos
Muchas gracias por tu aporte, de hecho tengo exactamente el mismo ejercicio y me encantaria una explicacion mas profunda, por lo menos entender antes de copiar , en el de moles del cloro porque dividimos su masa entre 111? y como tal explicacion mas explicita de estos Gracias quimico!
Hola. Dame más detalles del ejercicio.
Hola! Este material me ha sido de mucha ayuda y antes que nada queria darle las gracias!
Necesito resolver esto y se me esta haciendo un poco complicado. Espero de todo Corazon me puedan ayudar! Gracias anticipadas!
. Dado que 7.9 moles del gas monóxido de carbono están presentes en un recipiente con un volumen de 40.7 L, ¿Cuál es la presión del gas (en atm) si la temperatura es
52°C?
Hola tenes que ir al post de gases ya que ahi pongo las ecuaciones para resolver estos ejercicios según las leyes de los gases ideales. Una de las ecuaciones es la ecuación general que dice P x V = n x R x T
n = número de moles
R: constante universal de los gases.
T = temperatura. Debes pasarla a Kelvin sumandole 273 = 325 K
P = n x R x T / V
P = 7.9 moles x 0,082 atm l /K mol x 325 K
P = 5.17 atm.(atmósferas)
Entra ya al post de gases asi entendes cualquier problema de estos.
Ola me podrian ayudar Con
Una disolucion al 18% por volumen de alcohol en agua contiene:__________de alcohol y _________ de agua
Porfa Son los porcentajes
Gracias
18 ml (mililitros) de alcohol y 82 ml de agua
Si en un ejercicio me pide que halle la cantidad química, tengo que hallar la masa?
Francamente jamás escuche que diga la cantidad química. Pero si viste eso posiblemente se refiera a la masa de soluto
hola ,muy buena tu informacion me sirvio mucho . sera q me puede decir las formulas y despejes de las unidades quimica de concentracion de soluciones . por favor me lo puedes dar ahorita de verdad me urge …
Hola. Las fórmulas?. Esta todo en el artículo.
Me puedes colaborar con este ejercicio por favor:
A un recipiente que contiene 200 mL de solución acuosa 0.2 M de H2SO4 se le agregan 10 mL de H2SO4 puro (densidad=1.83 g/mL). Suponiendo volúmenes aditivos, calcular para la solución resultante normalidad
Si. Debes calcular el número de moles totales y despues de equivalentes en este caso. Por ejemplo en la primera solución tenés: Moles = 0,200 lts x 0,2M = 0,04 moles. Como el H2SO4 tiene 2 hidrógenos la cantidad de equivalentes es moles x 2 = 0,08 equivalentes. Ahora los eq de la otra solución. Pero de la otra no tenes la Molaridad la debes calcular de la densidad y del % de pureza que es del 100% por ser puro. M = 1,83 grs/ml x 1000 ml/litro x 1 mol/98 grs = 18.67 M (molar) por lo tanto tiene 18,67 M x 0,01 litros = 0,187 moles o sea, 0,374 equivalentes. Si sumamos tenemos 0,08 equivalentes + 0,374 equivalentes = 0,382 equivalentes en total al mezclar ambas soluciones. Entonces N = equiv/litros. N = 0,382 equiv / 0,21 litros = 1.82 N de la solución final. El volúmen de 0,21 litros se obtuvo sumando los volúmenes aditivos. Espero te haya servido
¡Muchas gracias!, pero según la respuesta que nos envió el profesor, la normalidad debería dar 1, 53 ; la verdad no tengo idea de porque da este resultado, y ya he mirado otras formas también, de todas formas muchas gracias
Es posible que tu profe se haya equivocado los pasos q te di son los correctos. Ahora lo q me hizo dudar es la falta de un dato del % de pureza q no me lo diste del H2SO4 si ese dato no es del 100% ahi si podria dar lo q dijo tu profe. Revisa bien tu enunciado besos
0.08+0.374=0.382 ??????? estas grave,,,,
No. Ese error lo comete cualquiera. Ahora pedir lo mismo 5 veces no es normal jaja. Usa mejor tu tiempo.
hola,quisiera saber si trabajar todos los dias con solvente,respirarlo y tocarlo es perjudicial para la salud.
Hola Miguel. Depende de el solvente que uses. Por ejemplo el benceno o el tolueno son bastante perjudiciales. Otros no tanto
Me puedes colaborar con este problema por favor:
Se tienen 800 ml de agua, a los que se le agregan 65 g de FeCl3 y sabiendo que la densidad del agua es prácticamente de 1 g/cm3 ¿Cual es el por ciento en peso de la sal?
Si la densidad del agua es 1 significa que la cantidad de mililitros es igual a la cantidad de gramos en peso o sea, 800 grs. Por lo tanto en total tenes 800 grs de agua + 65 grs de la sal = 865 grs de solución.
% P/P (Porcentaje peso en peso) = 65 grs soluto/865 grs solución x 100 = 7,51 % P/P (Peso en peso).
hola Profe, por favor me puedes ayudar con este dato que tengo, quiero saber que % se debe tener de una relacion de 200 gr/litro en cuanto a fertilizantes y como calculo los elementos secundarios y menores para obtener el grado?
Nitrogeno 200gr/litro, molibdeno 0.03 gr/litro
Hola sinceramente a q te referis con elementos secundarios y menores??
Hola, me puedes ayudar con un ejercicio, Como preparas 1 litro de solución 1N de NaOH, y que cantidad de NaoH se requiere pesar. Que cálculos necesito hacer? Gracias
Si claro. Si es 1 N es 1 equivalente en un litro de solucion entonces, debes pasar ese equivakente a gramos. Aquí un equivalente tiene el mismo valor de un mol ya que se calcula dividiendo el peso molecular por la cantidad de OH que es 1 por lo tanto de lo mismo, 40 grs. Pesamos 40 grs y diluímos a 1 litro con agua destilada. Besos.
Hola necesito ayuda,necesito ejemplo de 3sustancia y 3 fases,1 sustancia y 3 fases,4 sustancia y 2 fases,5 sustancia y 4 fa Es,2 sustancia y 4 fases..
Hola el problema 8 de la parte de Molaridad , dice: 0.08+0.374=0.382 , me parece que esta erroneo ya que con esa suma debo calcular mi nueva normalidad chekealo porfa….
Ya esta corregido jaja no te pongas nervioso lo dijiste 5 veces en 15 minutos. Estas grave vos.
Hola, necesito ayuda con este problema:
Si tenemos una disolucion de sal en agua con una concentracion de 20 g/l :
Calcula la massa de sal que hay en 50 listros de solucion
ayyyuda porfavor!!
Si en 1 litro tenes 20 grs de sal en 50 litros habra:
50 litros x 20 grs / 1litro = 1000 grs
felicitarlo y agradecerle si me ayuda por favor con lo siguiente:
cual es la masa de 10m3 de aceite? que volumen ocupa 1000 g de aceite? densidad del aceite : 9g/cm3
cual es el hielo de masa 184g y densidad 9 g/cm3
la masa del vidrio que tiene volumen 50 cm3 y 26 g/cm3 de densidad
el volumen del agua del mar en cm3 del agua del mar que tiene masa 510g y u na densidad de 1g/cm3.
gracias
Densidad es igual a masa sobre volúmen. D = M/V. Por lo tanto masa = D x V entonces masa = 9 grs/cm3 x 10 cm3. Masa = 90 grs. Del hielo te referis al volumen?. Practica lo mismo con el hielo, el vidrio y el agua de mar porque es la misma formula.
La verdad fue de gran ayuda todo lo que explicaste…me podrías ayudar con un problema?
Tenemos 350 ml de una solución de acido sulfúrico que presenta una concentración de 19% p/p y una densidad 1,5 gr/ml. Calcule la N de la misma! T agradecería si me ayudas!
Hola lorena debes usar los factores de transformación.
19 grs sto / 100 grs solución x 1,5 grs solución / 1 ml solución x 1000 ml solución / 1 litro x 1 mol soluto / 98 grs soluto = 2.9 M (molar)
En el caso del ácido sulfúrico un mol tiene 2 equivalentes. El peso del equivalente en un ácido se calcula dividiendo el Peso molecular por la cantidad de hidrógenos. Entonces en 98 grs habrán 2 equivalentes. Por lo tanto 2,9 M será 5.8 N (normal).
Buen día. Un gusto saludarles a todos ud.
Una consulta, ya que veo que tratan sobre soluciones. En el caso que yo tenga una solución ya preparada de un producto «X». Que metodología puedo usar para medir la concentración de esa solución ya preparada (no se que cantidad del producto «X» se uso para la dilucidan en agua).
Muchas gracias por sus respuestas
Hola Eduardo hay varias maneras. Una muy ilustrativa lo hice en el ultimo post. Como calcular la concentración de una base o un ácido a partir de la valoración o titulacioón con otra solución de concentración exactamente conocida. Fijate en el ultimo post si lo ubicas y decime.
buenaso me sirvio un monton
Tengo una materia prima con un 27.7% en solidos, este lo quiero llevar a una solución con una concentración de 20% en solidos. Me estoy enredando, y necesito ayuda. Digame como le hago? M
Le debes agregar solvente para q la concentración baje a 20%. Los 27,7 grs del principio ahora representaran otro % o sea, el 20%. Por lo tanto el 100% sera la masa de la solución:
masa solución = 100 x 27,7 / 20 = 138.5 grs. A esta masa se le resta la masa de soluto y queda, 138.5 grs – 27,7 grs = 110.8 grs. que es la masa de solvente. Como al principio los 27,7 grs de soluto estaban con 72,3 de solvente ya que ambos hacían el 100% ahora para pasar de 27,7% a 20% habrá que colocarle a los 72,3 g de solvente agua hasta llegar a 138,5 de agua y asi llegar al 20% m/m (mas aen masa).
Tengo un problema, como resuelvo esto ¿cuantas partes por millon tendra una mezcla de 1.5 kg. si esta tiene 5 mg. de calcio?
ayudame por favor
Hola. Primero para esto las unidades deben estar unificadas. Por ejemplo ambas en miligramos. Asi que nabrían (5 mg / 1500000) x 1000000 = 3,33 partes por millón. O sea, se divide la cantidad menor por el total y se la multiplica por un millón.
Me enseñaron en la esc. que partes por millon es el %m/m . 10,000
noooo no te pueden haber enseñado eso jaja. sosn dos cosas distintas.
hola..me ayudas?
determino los gramos de acido fosforoso necesarios para preparar 250 ml de solucion acuosa 2.8m, si la densidad de la solucion es de 1.83g/ml..
gracias!
Hola. Con los datos no hay forma de hacerlo ya que al pedirte molalidad y no molaridad necesitas datos del solvente y no tenes ninguno
Man tengo un problema y la verdad no encuentro la formula adecuada para hacerlo…
Calcular los moles y los gramos de soluto que hay en:
a) 2L de solucion de HNO3
b) 200mL de solucion de HCl
c) 20mL de solucion de H2SO4
LA verdad no se si comenzar primero calculando las moles del soluto y despues hacer algo con el volumen…
Gracias 🙂
No se pueden hacer ya que no pusistes los datos de las molaridades de los solutos algo fundamentales para el calculo entendes?. Ya que molaridad es moles dividido volumen en litros.
Otra cosa. Cuando te dirigis a una persona debes hablar correctamente. Mas alla de que sea hombre o man me llamo Patricio o podes decirme profesor. Gracias
hola profesor me podría pasar las respuestas des sus ejercicios: 1, 2, 4, 5, 8, y 10.. porque intente practicar y no se si me salieron bien… por favor ayúdeme un beso… gracias.. 🙂
Maria nose cual es tu duda. Alli estan todas las respuestas
gracias exelente sitio has ayudado mucho a mi hija felicitaciones por este esfuerso para ayudar a los demas.
Gracias a vos por leer mis trabajos. Ayudanos a difundoir el sitio. Les mando besos y bendiciones
muy buena la informacion me cirbio de mucha ayuda gracias!!
Hola me podrian ayudar con este ejercicio por favor : Cual sera la NOrmalidad de una solucion de nitrato de calcio Ca(NO3)2, que resulta de mezclar 190ml de solucion 0.25 N , con 260 ml de solucion 0.15 N de la misma sal. Espero me ayuden. Gracias.
Hola. Primero debes calcular la cantidad de equivalentes de cada solucion por separado. Luego los sumas y lo dividis por el volumen total en litros. Asi ya tendrás la N de la solucion resultante. N de equiv = N x V. N de equiv = 0,25 N x 0,19 lit = 0,0475 equiv. N de equiv = 0,15 N X 0,26 lit = 0,065 equiv. Equiv totales = 0,11.
N = 0,11 equiv / 0.45 lit = 0.24 N
hola mira es que el resultado del segundo ejercicio me da 278,4 gramos de AgOH … sera que me puedes pasar la solucio por la cual te da este resultado, es que ya lo hemos resulto en grupo de estudio y no nos da tu resultado …
Hola nose a cual te referis. Detallame el enunciado.
hola muy biennnnnnnnnnnnnnnnnnnnnnn
como se determina la cantidad en grs de NaOH necesarios para preparar 500 mililitros de solucion 2.75M???????
ayudaaa urgente :'(
Debes calcular la cantidad de moles. Moles = volumen x molaridad. Moles = 2,75 x 0,5 litros = 1,37 luego los pasas a gramos y listo.
1) Se tienen 100 ml de una solución formada por:
1.66 g de PO4 H2 Na. H2O ( fosfato monobásico de sodio) ( PM: 156.02) Y
15.5 g de PO4 H Na2 .12 H2O ( fosfato dibásico de sodio dodecahidratado)
Calcular el aporte de fósforo en mg/ ml. Rta: 16.7 mg/ml
me lo podrias explicar ? Gracias !!!
Debes sacar la cantidad de P de cada sal. Con regla de tres lo haces. En la primera sal de PM 156.02 grs. (calculalo porque me parece q esta mal). En esta cantidad hay 31 grs de P ya que hay un átomo en la molécula. Entonces hacemos 1.66 grs x 31 grs / 156.02 grs = 0,33 grs. Haces lo mismo con la otra sal. Su PM sería 358. Entonces. 15,5 x 31/358 = 1.34 que sumado a la masa de 0,33 nos da 1,67. Esto es en 100 ml asi que en 1 ml sera la centesima parte. O sea 0,0167 grs equivalente a 16.7 mg. Espero hayas entendido. Besos
necesito ayuda con esos 4 ejercicios no consigo como hacerlos, le agradeceria mucho si me ayuda.
Son muchos problemas y veremos si tenemos el tiempo para resolverlos.
Nos dedicamos a responder dudas puntuales y no la realizacion de trabajos practicos completos. Sino deberiamos cobrar por dedicar tanto tiempo a la resolucion de ejercicios.
muchas gracias, he entendido todo lo de el despeje que a mi profsor no le había podido entender gracias..
Esa es nuestra funcion. Ayudar. Nos alegramos mucho
Hola, buenas tardes.-
Me podrias colaborar con lo siguente.
¿En que casos realizamos la aplicación de porcentaje de pureza?
Muchas Gracias.
Hola María en muchos casos depende del problema que te pida. Por ejemplo te puede decir en una parte que tenes hidroxido de sodio al 88%. Entonces si o si vas a tener q calcular cuanto realmente es puro para saber cuanto reaccionara, entendes?. En la parte de estequiometría veras muchos ejercicios asi. Besos
Alguien puede ayudarme con este problema?
Se tiene 2 L. de solucion 1.50 m. de MgCl2, cuya densidad tiene un valor 1.21g/ml. Determina M y N de la solucion.
Ayudar Por favor! 🙁
No hay manera, necesitas el porcentaje masa en masa sino no hay manera
Si tendrias abie darme una respuesta..
Tengo una solucion de cloro de 100gs/Lt (concentrado) y quiero llegar a una disolucion de 5 ppm (cinco partes por millon)
Cuantos Lts . tengo que agregarle a un cc de cloro?
Desde ya … muy agradecido
juan stacul
La preg esta mal hecha. Si vos queres saber como llegar a una solución a partir de otra es una cosa. Pero despues ma hablas de 1 cc de cloro. Supongo q te referiras a 1 cc de cloro de la solucion concentrada. 100 grs/litro sería 1 en 10 partes. Ya q es un gramo en 10 ml. Un cc de cloro representa una concentración de 1 en 10. Asi q diluyendolo a 1 litro o sea 1000 ml sería 1 en 10000. Entonces a 100 litros llegarías a 1 ppm. Para 5 ppm serán 500 litros de agua.
Por favor me podrias ayudar con este ejercicio:
El carbon activado es un producto de la naturaleza organica,que sirve como «adsorvente» de algunas sustancias que causan intoxicacion por ingestion. Se usa el 8% p/v en solucion de h2o. Indique como prepare 1300ml,ademas se usa a razon de 7ml/kg,por lo tanto indique cuanto carbon usaria «expresado en gramos» en un paciente de 84kg.
Una pregunta, sabes hacer ejercicios que de refiera a goteos? Lo que se usa en el hospital. Muchas gracias.
Hola nose a que te referis con goteos
Que molaridad tendrá una solución que fue preparada añadiendo 46 grs. de Ca(OH)2 al 79 % de pureza a cierta cantidad de agua obteniendo un volumen final de 4200 ml. En este ejercicio al final no me da la molaridad si no que me da 0,111 por favor, explicame para hacerlo.
gracias
Lo ideal es ir haciendolo con los factores de conversion.
46 grs x 0,79 x 1 mol/74 grs = 0.49 moles
M = 0,49 moles/4.2 litros = 0.117 M Este es el resultado final. Parecidisimo al q te dieron. Este es más exacto.
Por favor me podrias ayudar con este ejercicio:
El carbon activado es un producto de la naturaleza organica,que sirve como “adsorvente” de algunas sustancias que causan intoxicacion por ingestion. Se usa el 8% p/v en solucion de h2o. Indique como prepare 1300ml,ademas se usa a razon de 7ml/kg,por lo tanto indique cuanto carbon usaria “expresado en gramos” en un paciente de 84kg.
84 kgs x 7 ml = 588 ml. Para hacer 1300 ml hacemos x 8 / 100 = 104 grs de carbon activado. Entonces si se usa entonces 588 ml para una persona, se usan 588 x 104 / 1300 = 47 grs de carbon activado
con goteo me refiero con este ejercicio: Por favor te re agradeceria si me lo pudieras hacer, necesito saberlo para un final.
Se recibe un paciente por guardia, al cual le indico ampicilina 1000mg c/8hs
El P.H.P indicado fue de 21 gts x min alternados.
El paciente se le da el alta a los 4 dias,indique:
1) volumen de cada una de los soluciones parenterles administradas al cabo de los 4 dias.
2) Volumen total de soluciones parenterales administrados al cabo de 4 dias.
3) Cantidad de ampicilina administrada expresada en gr. en los 4 dias de internacion.
Ese lenguaje es de medicina o farmacia lamento no ayudarte
Buenas noches profesor, quiero felicitarlo por esta página y al mismo tiempo necesito su ayuda.
El ejercicio es el siguiente:
Dos soluciones acosas que la primera con glicerol y la otra con sacarosa hierven a la temperatura de 101.32 grados centrigrados. ¿Cuál será la molalidad de ambas soluciones? Diga la temperatura de fusión. Ke=0.52 kc=1.82
Muchas gracias
Iolanda busca propiedades coligativas en mi página. Así ves la teoría y la entendés. También verás ejercicios. Este tema es propiedades coligativas.
Necesito tu ayuda para este ejercicio x favor tengo q rendir mañana temprano y se me complico con este ejercicio.
*El metano (CH4) forma parte del gas natural ¿Cuantos moles de gas hay en 10g de metano?
¿Cual es el numero de moléculas del sistema?
¿Cuantos átomos de carbono hay en esa cantidad de gas?
¿Que volumen ocuparan esos 10g de metano si se encuentran a 32°c y a 1,4 atm?
Te ruego que me ayudes x favor
Gracias!!
Hola por razones de tiempo es dificil es una preg larga. Pasa los grs a moléculas con el factor de conversion. 10 grs x 1 mol/16 grs x 6.022×10 a la 23 moléculas/ 1 mol = el numero que te de en moleculas. tacha las unidades y te quedara en moleculas.
Hola necesito que me ayudes con este problema no lo pude resolver lo necesito para mañana.
el metano (CH4)forma partes del gas natural:
¿cuantos moles de gas hay en 10g de metano?
¿Cual es el numero de la molecula del sistema?
¿cuantos atomos de carbono hay en esa cantidad de gas?
¿que volumen ocuparan esos 10g de metano si se encuentran a 32°c y a 1,4 atm ?
POR FAVOR.. ES PARA RENDIR ¡¡¡GRACIAS!!!
Tu preg es muy larga ya no respondo por razones de tiempo. Lee el post q explico perfectamente como resolverlos y lee lo de gases
es de lo mejor que encontre en internet!!!!!
Hola Thiago gracias te comento q pronto lanzaremos el ebook de química con todos los temas detallados tanto en teoría como en practica. Si estas interesado contactanos. Esta supercompleto
me puedes resolver las 5 primeras de los problemas para resolver 🙂 grasias
No la idea es q lo resuelvan uds. Te comento q esta a la venta el libro electronico de quimica y esta muy completo
Hola muy buen sitio de verdad, tengo una duda cuando te piden calcular la m y la M pero en el enunciado te dicen solo lo siguente: se tiene una solución acuosa de CaCO3 al 25% m/v la densidad de la solución es 1,03 g/ml no logro resolverlo xfavor ayuda..
A ver es largo de explicar pero se hace rapido con los factores de conversión. Si multiplicas 25 grs/100ml x 1000 ml/1litro x 1 mol/100 grs obtenes la molaridad. Vas cancelando las unidades para que queden moles/litro. Los 25 grs estan en 100 ml de solución que se cancelan con los 1000 ml que estan en un litro. y los grs de los 25 grs de soluto se cancelan con los grs de los 100 grs a lo último q representan a un mol de la sal, en este caso CaCO3.
es una buena forma de explicar un tema por que asi aprendemos cada vez cada forma dede manejar la quimica para asi llegar a ser alguien en lqa vida…
¿Cuantos gramos de acido acetico comercial 97% en masa de C2H4O5 deben reacionar con exceso de PCl3 para obtener 75g de cloruro de acetilo C2H3OCl ,si la reaccion tiene un rendimineto del 78%
C2H4O2+PCl3————–C2H3OCl+H3PO3
porfa una ayuda para resolver
Lo siento no disponemos de tiempo para contestar estas preguntas. Te recomendamos que adquieras el libo electronico q cuenta con numerosos problemas.
que tal saludos
cuantos litros de peroxido tengo que agregar en 400 litos de agua si mi concentracion es de 35%
Hola. La concentración de volumen en volumen (V/V) es % V/V = (volumen soluto / volumen solucion) x 100 Por lo/ 100 tanto si despejas al V de soluto queda:
V soluto = (% V/V x V solucion) / 100
V = 35 % x 400 litros / 100 = 140 litros.
Si me podrias ayudar con este problema:
En esta ecuacion : Na+H2O —–> NaOH+H2+calor
¿Cual seria la especie oxidada? …. Desde ya mi eterno agradecimiento
El sodio sin dudas. Pasa de úmero de oxidación cero al estar solo a la izquierda a tener +1 a la derecha
Estimado tengo el siguiente problema
Le solicitan preparar una solución de Sulfato de Cobre (CuSO4) 0,18 M.
Para esto, le entregan una muestra con 50 gramos de CuSO4 y 400 ml de agua, los cuales debe ocupar en su totalidad.
¿Cuántos gramos de CuSO4 son necesarios pesar, para preparar la solución indicada?
Me podrías ayudar o guiar a realizar este ejercicio desde ya muchas gracias.
Hola Pascual. En primer lugar con la M y el volumen de 400 ml (0,4 lts) calculas los moles del soluto. Despues lo pasas a masa.
moles = M x V = 0,18 M x 0,4 lts y con el peso molecular los pasas a gramos. Esos gramos son los que se disuelven en 400 ml de agua. Hacelo y despues me contas.
Buenas tardes! puedo pedir ayuda con esto? ya que pedi 3 veces que me explicaran y sigo sin entenderlo
se tiene una solucion A cuya concentracion es 50% m/m. la densidad de la solucion A=1.5g/ml y la densidad del soluto que forma parte de la solucion A=0.90gr/ml . teniendo en cuenta estas densidades, expresar la concentracion de la solucion A en %v/V y en %m/v
muchas gracias
Hola para pasar de % m/m a % v/v debes pasar las masas de soluto y solución (50 grs y 100 grs) a volumenes ya que tenes ambas las densidades. Densidad es masa sobre volumen (d=m/v) entonces
V = masa / d. Si es 50 % m/m hay 50 grs de soluto, entonces v = 50 grs / 0.9 grs/ml. V = 55.55 ml. Para la solución se hace lo mismo.
V = 100 grs / 1.5 gr/ml = 75 ml. Con estos dos datos de volumenes sacamos el % v/v.
% v/v = 55.55 ml / 75 ml x 100 = 74.06 % v/v
Para el % m/v ya tenes los datos:
% m/v = 50 grs / 75 ml x 100 = 66.66 % m/v
Buena tarde disculpa tengo el siguiente ejercicio y el resultado no me da de acuerdo a la solución que realizo ¿Cuantos mililitros de agua hay que añadir a 7 g de sal para que la solución tenga la concentración del agua de mar (3%)
Hola. S tenes 7 grs de sal pura, para alcanzar una conc del 3 % m/v (masa en volumen) debes hacer el cálculo en base a esta fórmula que expuse en el artículo.
% m/m = masa soluto/masa solvente x 100
despejamos masa solvente (agua). masa solvente = (masa soluto / % m/m) x 100
masa solvente = 7 grs / 3 % m/m x 100
masa solvente = 233.3 ml de agua destlada.
O sea debes agregar 233.3 ml de agua destilada (pura) con 7 grs de sal pura y disolverla.
ayuda con estos problemas son los mismos que estan en esta pagina pero con los valores y numeros aumentados ayudaaa GRACIAS
1) Calcula el % v/v de una solución que tiene un volumen de 1800 ml y 1080 ml de agua (solvente).
2) Que masa de AgOH se necesitara para preparar 2 litros de una solución 0,5 M en este soluto.
3) Que densidad tendrá una solución de 1800 centímetros cúbicos y 2,1 kg.
4) Cuál será el volumen de una solución que tiene 30 gramos de soluto y una concentración de 8% m/v
5) Que masa de solvente se necesitará para hacer 250 g. de una solución al 5% m/m
6) Calcula la Normalidad de: HNO2 (3M) – KOH (0.8M) – H2SO3 (2,5M) – Al(OH)3 (4M) – Na3PO4(1.6M) – NaCl (2,2M).
7) Que volumen de solución ocuparan 5 equivalentes de soluto de una solución 4N.
8) Que m (molalidad) tendrá una solución que se preparó colocando 20 gramos de NaOH en 2000 ml de agua.
9) Como prepararía 2 litros de una solución 0.5 M a partir de otra que es 5 M.
10) Que molaridad tendrá una solución que fue preparada añadiendo 56 g. de Ca(OH)2 al 89 % de pureza a cierta cantidad de agua obteniendo un volumen final de 4700 ml.
La idea es que lo hagas vos. Para eso explico detalladamente y paso a paso los problemas. Mas si usas casi los mismos problemas de la pagina.
POR FAVOR ELQUMICO AYUDEME DEPENDO DE UD PARA PARA RECUPERAR QUMICA 3 PERIODO EN MI COLEGIO Y ESTOY EN GRADO 11 LE PIDO POR FAVOR AYUDEME LE SOY SINCERO NO SOY EL MAS APTO PARA QUIMICA PERO INTENTO PASAR EL AÑO COMO SEA AYUDEME SE LO RUEGO
TALLER SOLUCIONES Y UNIDADES DE CONCENTRACION
Problemas para resolver:
1) Calcula el % v/v de una solución que tiene un volumen de 1800 ml y 1080 ml de agua (solvente).
2) Que masa de AgOH se necesitara para preparar 2 litros de una solución 0,5 M en este soluto.
3) Que densidad tendrá una solución de 1800 centímetros cúbicos y 2,1 kg.
4) Cuál será el volumen de una solución que tiene 30 gramos de soluto y una concentración de 8% m/v
5) Que masa de solvente se necesitará para hacer 250 g. de una solución al 5% m/m
6) Calcula la Normalidad de: HNO2 (3M) – KOH (0.8M) – H2SO3 (2,5M) – Al(OH)3 (4M) – Na3PO4(1.6M) – NaCl (2,2M).
7) Que volumen de solución ocuparan 5 equivalentes de soluto de una solución 4N.
8) Que m (molalidad) tendrá una solución que se preparó colocando 20 gramos de NaOH en 2000 ml de agua.
9) Como prepararía 2 litros de una solución 0.5 M a partir de otra que es 5 M.
10) Que molaridad tendrá una solución que fue preparada añadiendo 56 g. de Ca(OH)2 al 89 % de pureza a cierta cantidad de agua obteniendo un volumen final de 4700 ml.
Julio lamento no poder hacerte estos ejercicios. Te explico. Imaginate si le haría a cada uno de uds esta enorme cantidad de problemas. Es humanamente imposible. Por eso escribi los post para que los lean y al entender la teoría puedan aplicarlo
ELQUIMICO DEBERIAS AYUDAR A ESE TAL JULIO GARCIA SE VE QUE NECESITA PASAR EL AÑO DEBEMOS AYUDAR A LAS PERSONAS ASI CREAMOS QUE ELLOS SOLO LO DEBEN HACER
HAZ UNA EXCEPCION TU SABES MUCHO DE QUIMICA AYUDALO 🙂
Kmilo lee lo que le conteste a Julio. Yo no voy a ayudar a cada alumno con todos estos problemas. No es un problema, son muchisimos. A mi no me da el tiempo para hacerle todas las tareas a cada uno de ustedes. Eso lo deben hacer ustedes, para eso van a la escuela y supongo que tienen la edad para entender como son las cosas. Yo le dedique innumerables horas de mi tiempo para hacerles ejercicios completos y muy bien explicados con la teoría correspondiente. Eso era para que lo entiendan y los apliquen en sus estudios, no para que se los haga yo. En la vida hay que aprender a ser responsables y hacerse cargo cada uno de sus responsabilidades.
hola me dejaron este trabajo y realmente no se como hacerlo, me ayudas?
Cual es el porcentaje p/v de una solución de ácido clorhídrico que en la etiqueta dice tener 38 % p/p y densidad 1,19 g/cc
Hola Flor, no acostumbramos a resolver aqui ejercicios porque son extensos pero hare la excepción. En primer lugar debes pasar los 100 grs de solucion del porcentaje que te dieron que tienen 38 grs de soluto (38 % P/P) a volumen, es decir, esos 100 grs cuanto sería en volumen. Entonces usas la densidad. La densidad es masa sobre volumen entonces, al despejar queda:
V = masa / d = 100 grs/1,19 grs/cm3 = 84.03 cm3.
En estos 84.03 cm3 hay 38 grs de soluto, ya que este volumen equivale a los 100 grs de solución anteriores. Ahora hay q ver cuanto hay en 100 cm3 de solución. Entonces:
100 cm3 x 38 grs / 84.03 cm3 = 45,22 % peso/V
Si quieres puedes poner me gusta en el sitio de quimica y automaticamente recibiras actualizaciones o tendremos un contacto mas fluido. Espero te haya servido.
Necesito ayuda para este problema:
-Calcular el porcentaje v/v del ácido sulfhidrico contenido en el agua
Y los datos numericos?. Sino sera complicado jajajaja
hola, mmuy interesante tu aporte. me preguntaba si me podias ayudar con este ejercicio.
prepara 500 ml de una solucion de HCl 1,5 M (eso si lo hice),de donde voy a sacar los 27 g que nesecito para preparar los 500 ml si el HCl no es puro?
Te dio 27 gramos?. Deberías tener la densidad y el % de pureza para sacar el volumen necesario ya que no es una droga solida
como calculo la molalidad de una solucion que e prepara disolviendo 25gr de ácido sulfurico en 100gr de agua….. respondame on la solucion por favor
Fácil. Calcula los moles del soluto, en este caso, ácido sulfúrico. Para esto dividis los 25 grs por los 98 gramos del peso molecular del soluto. Da 0,255 moles. Luego, dividis estos moles por los kilos de solvente. 0,255 moles / 0,1 kg = 2,55 molal.
me podrían ayudar con este ejercicio!?
Haber comenzó su experimento con una mezcla que consistía de N2 y H2, y permitió que la mezcla alcanzara el equilibrio con el producto, NH3, en un recipiente a volumen constante. El encontró, que en equilibrio a cierta temperatura, la concentración de NH3 era 0,10 M. ,de N2 era 0.9 M N2 y de H2 0.80 M . Calcular la constante de equilibrio para esta reacción a esa
temperatura y decir si predominan los reactantes o los productos
N2(g) + 3 H2(g) ===== 2 NH3 (g)
Hola, bueno lo que tenes que hacer es llevar esos numeros a la formula. Ya estan en molaridad asi que es mas fácil.
K eq = [NH3]2 / [N2] x [H2]3
Calcula ese numero y después decime
Hola, miren me dejaron este problema por favor ayuda
«Si una solucion es del 7% ¿cuantos gramos de soluto hay disueltos en 100g de disolvente?»
Si es 7 % a secas te estan diciendo 7 gramos de soluto en 100 gramos de solución. O sea la diferencia es de solvente es decir, 93 gramos. Por lo tanto en 100 gramos de solvente habrá algo más. Haces 100 x 7 / 93 y ese resultado será la masa de soluto en 100 grs. de solvente.
mañana es mi examen ¡¡¡¡¡¡no se que hacer¡¡¡¡¡¡¡¡¡¡¡¡
Estudia
mire men tu sabes como se despeja una solución y como ejemplo me dieron esto
si tengo una solución con una concentración de 16,7 % m/v.
cuanto azùcar necesito para preparar 750ml de una solución con la misma concentración.
El azúcar es el soluto. Para 100 ml necesitas 16,7 grs de azúcar. Entonces para 750 ml necesitarás:
750 ml x 16.7grs / 100ml = 125,25 grs
Chicos por favor leeeaaan hay problemas asi y mucho mas complicados y bien explicados en el artículo
yo digo lo mis mismo que nestor porque estudiar esta pagina es como dificil
El problema es fácil. Ya te di la solución y perdoname pero seré directo. Alumnos como vos son muy vagos. Les dejo el post lleno de problemas fáciles como el que me preguntastes y difíciles y encima no lees.
quiero saver la definicion de m/m, m/v, v/v pero en pocas palavras por favor el para 1 (7) año de secundaria
masa en masa, masa en volumen, volumen en volumen. Se refieren a porcentajes. Por ejemplo 2% m/m es 2 grs de soluto en 100 grs de solución.
necesito urgente tres ejemplos de soluciones que se encuentran en la naturaleza, y tres que se encuentran en el organismo, nombrando sus respectivos solutos y solventes y sus estados físicos por favor solo me falta eso en el informe para este viernes, desde ya muchas gracias.
No tuve tiempo de responderte pero no es difícil. Cualquier sal en agua es ejemplo. En nuestro organismo tenes or ejemplo el plasma de la sangre que es agua con sales, proteínas, grasas e hidratos de carbono
Ayuda por favooooor, no puedo realizar este ejercicio 🙁
El volumen total de agua de mar es 1,5×10^21 L. Suponga que esta agua contiene 9,7% en masa de cloruro de magnesio y su densidad es de 1,03 g/ml. Calcule la masa total de cloruro de magnesio.
Calculas la masa del agua de mar con la densidad y el volumen. Densidad = masa / volumen. Masa = D x V.
masa = 1,03 g/ml x 1,5×10^24 ml.
A este resultado le sacas el 9,7% y listo.
hola buenas noches!.. tengo un ejercicio que no recuerdo como se hacia, me podrias dar una mano?..
Tengo 250ml de una solución de Ac.Oxálico 0,1N PM=126g/mol 63g/eq.
tengo que expresar su concentración en unidades físicas..
gr/l mg/l y %p/v
desde ya muchas gracias! espero tu respuesta
[email protected]
Hola, bueno para pasar a gr/l deberás pasar los 0,1 eq a grs
0,1 eq x 63 grs/eq = 6,3 grs. A su vez estos 6.3 grs están en un litro pero tenemos 250 ml la cuarta parte. Entonces calculamos en 250 ml cuantos grs habrán. 250 ml x 6,3 grs / 1000 ml = este resultado será en grs/litro. Animate a hacer el otro.
me re sirvio gracias
De nada. Nos alegramos.
Holaa, me podrías ayudar con esta pregunta?:
¿Por qué cuando el solvente es agua la diferencia entre la masa del soluto y la del solvente corresponden al volumen de agua que se debe añadir a la solución?
gracias de antemano
No compares masa con volumen. La suma de las masas del soluto y solvente hacen a la masa total de solución
Hola, necesito urgente esta respuesta podrias ayudarme?
Si me dan la concentracion en g/l de una solucion, como puedo calcular el soluto que hay en 150 ml de ese disolvente?
Gracias
A ver, aclaremos. Si te dan la concentración en gr/Lt de solución podrías pasar primero a grs/ml o % m/v. Pero si te dan el volumen de solvente en vez de volumen de solución no se podrá. A no ser que tengas otro dato mas que te ermita sacar la masa de soluto.
ayuda tengo una duda para este: Que molaridad tendrá una solución que fue preparada añadiendo 46 grs. de Ca(OH)2 al 79 % de pureza a cierta cantidad de agua obteniendo un volumen final de 4200 ml
no se como se hace este
Hola, mira. Molaridad es moles de soluto dividido litros de solución. Los 46 grs pasalos a moles. Son 46 dividido el peso molecular que lo sacas fácil teniendo la fórmula. Luego ese resultado lo dividis por 4,2 litros que es el volumen pasados a litros.
buenas tardes me podrias ayudar con este pes el responsable del sabor del yogurth ¿calcule la molaridad que abra en 3.5litros de solucion?..(la formula es CH3CHCO2H) AYUDAME por favor
Hola, falta información. La masa del soluto
Hola, muy buen material excentente…. No sé si ya te comentaron, pero en el problema 1 q dejaste para q resolvamos, esta bien q el soluto sea mas grande q el solvente,y si fuese así el calculo a mi me dio 59%m/m
Lo resolví así 1400ml/2380mlx100
Espero tu ayuda…..
Hola Gaby debo decirte lamentablemente que esta mal. Los 1400 ml son de SOLUCION y los 980 ml son de SOLVENTE por lo tanto el volumen de soluto sale de la resta 1400 ml – 980 ml = 420 ml. Entonces el calculo es:
% V/V = (420 ml / 1400 ml) x 100
% V/V = 30 %
Como verás había trampa. Casi todos caen ya que no se dan cuenta que el volumen de soluto lo deben calcular de la resta que te explique. Abrazo y estoy para ayudarte.
La dencidad de acido sulfurico del acumulador de un carro es 1g/m²
Calcular la masa de 290ml de liquido y pasarlo a libras/pie³
masa = densidad x volumen
pero las unidades estan mal. 1 g/m2 no debe ser g/m3. Fijate bien.
hola esta muy bueno la explicacion yo que nunca vi esto me sirve ahora para enfermeria. despues pondre un ejercicio con el cual la profesora me hacho en el parcial.. muchas muchas gracias
Majo nos alegra q te haya servido.
mas ejemlos de soluciones
No entendí nadaaaaaa
Buenas Noches
Mañana es mi examen y este problema no me deja descansar parece simple pero es realmente dificil si lo pueden resolver estaria muy agradecido ¿Cuál es la molaridad y la normalidad de una solución al 12% de ácido sulfúrico (H2SO4)?
Hola perdona ya paso tu exámen pero no podes calcular esto que te piden solo con el porcentaje de pureza. Necesitas de la densidad.
Calcula el porcentaje de una solución que se prepara disolviendo 23gr de permanganato de potasio disueltos en 175ml de agua
Eso se calcula con la fórmula que puse para el porcentaje de soluciones masa en volumen.
% m/v = (masa soluto / volumen solución) x 100
Calculala que tenés todos los datos. Ante cualquier duda decime
Hola, quisiera saber como preparar una solucion de KCN 0,5 N. gracias
Hola. Pesas la mitad del peso molecular de la sal y lo disolves en un litro de agua destilada. Lee bien la teoría y verás porque te digo la mitad.
La verdad que esto es un buen sitio.. Me ha ayudado muchisimo 😀
En otros sitios me dava flojera leer tanto pero en est me entuciasmo mucho 🙂
Beso :*
hola
Hola.
TENGO UN PROBLEMON!!! 🙁 el ejercicio dice: La PIEDRA CALIZA es un mineral de alto contenido de CaCO3. Cuando se la somete a descomposición térmica se obtiene CaO como uno de los productos. La ecuación química que tiene lugar es la siguiente: CaCO3—> CaO+CO2
Si a partir de 200kg de piedra caliza se obtienen 92,0 kg de CaO, determine la pureza en CaCO3 de la PIEDRA CALIZA.
Seleccione la opción correcta entre estas 4: a)100% b) 82% c)60% d)95%
… Como lo resuelvo??????. desde ya mil gracias
Oka Sonia. Mira, habría que calcular cuanto CaO habría obtenido si los 200 kgs de CaCO3 son puros.
Con 100 kgs de CaCO3 obtendrías 56 de CaO. Con 200 entonces se obtendrían 112 kgs del óxido. Pero obtuvistes 92 kgs. Entonces los 112 kgs de CaO estan ligados al 100% de pureza del carbonato. Para 92 kgs?.
92 x 100 / 112 = 82.14 %.
hola puedes ayudarme con esto porfaaaaa?
1)al neutralizar 400 ml de cierta disolucion de hidroxido sodico se gastaron 180 ml de acido clorhidrico, 0.15N. calcular la normalidad de hidroxido de potasio
2) queremos preparar 450 cc de disolucion 0.35N de hidroxido de bario. disponemos de la base cristalizada con 10 moleculas de agua. ¿cuantos gramos se necesitan de esta base de hidroxido, para preparar la solucion?
Primero decís hidróxido de sodio y luego hidróxido de potasio, de todos modos es lo mismo para estos fines. Usa la fórmula:
N1 x V1 = N2 x V2
Es decir, normalidad de ácido por volumen de este es igual a la normalidad del hidróxido por le volumen de este. Despejas la N del hidróxido y listo.
El otro es mas largo, primero debes calcular la cantidad de equivalentes de la base.
N° de eqquivalentes = Volumen x Normalidad
N° de Eq = 0,45 litros x 0,35 N = 0,157 equiv.
En el caso del hid de bario tenemos en un mol 2 equiv por lo tanto tenemos 0,314 equivalentes.
Los pasas a gramos y después ajustas con una regla de tres por le tema de las moléculas de agua. Pensalo cualquier cosa decime.
Hola, por favor podría colaborarme con este ejercicio?
Realizar los cálculos para: 5. Preparar 100 cm3 de una disolución 0.5 M de ácido clorhídrico (HCl) a partir de ácido clorhídrico comercial (36% p/p y densidad 1,18 g/mL).
Le agradezco.
con el porcentaje y la densidad calcula la molaridad de la segunda solución de HCl. Eso lo explique perfectamente en el artículo. Entonces ya tendrás dos molaridades y un volúmen. Te faltara el segundo volúmen. Usa esta fórmula:
M1 x V1 = M2 x V2
Despejas V2 y ya esta. A ese volumen que te de le agregas agua hasta llegar a 100 cm3 que es lo q te pide.
no puedo resolver este problema lo intente varias veces y no me sale me podrian ayudar por favor…. se mezclan 100ml de una solucion acuosa de sulfato(IV) de hidrogeno 1,00.10 a la menos unos N con 100 ml de otra solucion acuosa del mismo soluto 1,00.10 a las menos uno M .suponiendo que los volumenes son aditivos calcule la normalidad de la solucion resultante.
por favor ayudenme no la entiendo encima es para prepararme para una prueba por favor ahh perdon es que no me sale poner uno por diez a la menos uno …. gracias
No te entiendo bien los numeros de Normalidad
no entiendo muy bien la química. tengo un problema y no he podido resolverlo. me puedes ayudar?
2M de CaCO3 con una d=1,36gm/ml. hallar m/m, m/v, v/v, N y ppm.
te lo agradeceria
Hola Mery es muy larga la resolucion pero tengo explicado esos problemas en el post q viste. Por ej si es 2M son dos moles en un litro. pasas esos moles a masa con el peso molecular. Te armas una regla de tres simple.
en 1000 ml —– 200 grs (2 moles)
en 100 ml —— x = y este resultado es el % m/v (masa en volumen).
hola por favor me podria ayudar con este ejercicio???
En la etiqueta de un recipiente de hcl de 500ml se leen los siguientes datos … densidad 1.19 kg/l y 37% p/p ¿determinar la moralidad y normalidad de esta solucion???
Hola Erika, bueno ahí explico ejercicios como este. Acá es complicado explicarlo. Deberás multiplicar la densidad x 1000grs x 37 grs/100grs x 1 mol/peso molecular. Los 1000 es para pasar de kilo a gramo de solución. Los 37/100 es para pasar de grs de solución a grs de soluto. Pero mejor lee los ejemplos.
hola profe este material esta bueno si no que me confundo un poco es haciendo las operaciones porq por ejemplo en algunos ejercisios se multiplica por 100 y otras veces se divide y asi va variando y pues yo aveces lo hago todo es multiplicando y pues me quedan mal quisiera saber que se tiene en cuenta para saber cuando se multiplica y cuando se divide gracias por la atencion y la informacion
Ahí se explica bien Paulo, es solo respetar las fórmulas.
Si gracias, a mí me a servido un montón. saludos.
fontaneros madrid,fontaneros,fontanero,fontanero Madrid, fontaneros Fuenlabrada
¡como preparia 800mL de una solucion saturada de KN(O)3 a 10°C sabiendo que la densidad de dicha solucion es de 1.08g/mL? ME AYUDAS CON ESTE PROBLEMA PORFAVOR =)
ME FALTO SI A 10°C es 20g de KNO3/100 g de H2O
la respuesta es 144g de KNO3 en 720 g de agua pero quiero saber el proceso
No entiendo. Poneme el enunciado completo.
Sinceramente nose para que te dieron la densidad si medis directamente el volumen. Medís 800 ml y le agregas mas sal (KNO3) hasta que no se disuelva más.
cuanto moles de soluto hay en 5 litros de solucion 2,0 M?
De que componente?. Sino es imposible calcularlo.
se desea preparar una s/n de NaOH al 19%m/m,cuyo volumen sea de 100ml la densidad de la s/n es de 1.09g/ml¿cuantos gramos de agua y de NaOH SE DEBEN USAR?
masa de solución = densidad x volumen
masa Solución : 1.09 gr/ml x 100 ml = 109 grs. Si de esta calculamos el 19% nos da:
109 x 0.19 = 20.71 grs de soluto.
el resto es agua. 109 grs – 20.71 grs = 88.29 grs de agua.
que concentracion en % m/m tendra una solucion preparada con 20.0g de NaCl y 200.0g de agua
20 + 200 = 220 grs de solución. Esta masa representa el 100%. Por lo tanto los 20 grs de soluto son el:
20 x 100 / 220 = 9.09 %
gracias por las soluciones que me resolviste,pero tengo otro ploblemita
se obtiene una solucion de (c)=33.5% m/v.
¿que significa 33.5% m/v?
¿que densidad posee la solucion si 100.0 mL de ella pesan 111.0 g?
33,5 % m/v es 33,5 grs de masa en 100 ml de volumen. La densidad es masa / volumen = 111 grs/ 100 m = 1,11 grs/ml
al mezclar 13.5 g NaOH con 56,8 g de agua se obtiene una solucion cuya densidad es de 1,15 g/ml. determine el % m/v de la solucion resultante
masa solución = masa soluto mas masa solvente.
masa sol= 13,5 + 56,8 = 70.3 grs.
densidad = masa / volumen
V = masa / dens
V = 70,3 grs / 1,15 g/ml = 61.13 ml
Ahora calculamos el % m/v
100 x 13,5 grs / 70.3 grs = 19.20 % m/v
hola me ayudas porfa en estas soluciones….
una solucion acuosa es de 35.0 % m/m ¿cuanta agua hay que agregar a 80.0 g de esta solucion para que se transforme en una de 20.0 % m/m?
En 80 grs de la primer solución hay 80 x 35 / 100 = 28 grs de soluto. A partir de aca agregamos agua para llegar a un 20 % de soluto en solución. O sea que si para 20 grs de soluto hay 100 de solución, para 28 de soluto habrán, 140 grs de solución. El resto es agua. O sea que 140 grs – 28 grs = 112 grs de agua. En la primer solución de 80 grs tenemos 28 grs de soluto y 52 grs de agua. Para llegar a 112 de agua agregaremos, 60 grs de agua y asi llegamos a los 112 pedidos para completar la solución de 20% m/m.
desde ya te doy mil gracias si me puedes ayudar con este problemon….se le estima ya que esto es una buena tecnica y deverdad que una pagina de mucha importancia e interes para quienes queremos salir adelante.
Anita te hice varios problemas pero no puedo hacerte todos por razones de tiempo. Otras personas cobrarían por esto ya que se consume mucho tiempo. Hice una excepción, pero si entendes lo que escribo en mi artículo sabrás hacerlos tu misma. Esa es la idea.
DE TODAS FORMAS GRACIAS POR TODO ASI ESTA BN DE NUEVO MIL Y MIL GRACIAS…..
De nada besos.
Necesito ayuda en este problema por favorr! Se usa una pipeta para mefi 25 ml de HCl 0,1027M . Se vierte el contenido de la pipeta EB un matraz adorado de 100 ml. Se añade agua destilada al enrase. Cual es la conetracion de la solución diluida?
Hola. Los 25 ml de HCl 0,1027 M representan 0,025 lts x 0,1027 M = 0,0025 moles. Estos ahora estan en un volumen de 100 ml. Por lo tanto su nueva molaridad será:
M = 0,0025 moles / 0,1 litro = 0,025 M
una consulta digamos que mezclo 100g de un soluto X con 500 ml de solvente Y, ¿el volumen de la solucion tambien tendría 500 ml o estoy equivocado?
Hola Ricardo. Es buena tu pregunta. En el caso de los sólidos no se aumenta demasiado le volumen. En los problemas suelen decir que el volumen final es el del solvente. Pero en fin, si fueran 500 ml de solvente mas 100 ml de soluto ahí si será 600 ml de volumen total sino no. Estoy de acuerdo con vos.
Hola necesito ayuda con este problemita
La etiqueta de una botella de vino de 80 cl. aparece el valor de 15% vol. ¿que cantidad de etanol contiene la botella?
80 x 15 / 100 = ? eso es lo que contiene con ese calculo lo sacas.
gracias 🙂
Estamos para eso, me alegra que te sirva tatiana.
Hola maestro, por favor ayuda con este problema, me fui a la B con el ejercicio. Era como física cuántica en chino. Le estaré muy agradecido.
se disuelve una muestra de 0,0560 g de ácido acético (CH3COOH) en la cantidad suficiente de agua para preparar 50, 0 ml de disolución. Calcule las concentraciones de H+, CH3COOH- Y CH3COOH en el equilibrio. (Ka para el ácido acético = 1,8×10 elevado -5)
Por favor
Vicente entrastes al post equivocado, entra a este. Lee la teoría sino no entenderás nada. Lo prepare como los otros pot para ese fin. Entra aca ya:
http://www.quimicayalgomas.com/quimica-general/acidos-y-bases-ph-2/
Buen día Profesor:
Soy de México y me llamo la atención su blog, quiero hacerle una consulta general, cuando tengo 2 soluciones de concentraciones conocidas para prepara una tercera de características intermedias ¿como lo calculo? se que existe una relación, mi intucion me dice que se suman pero me resulta que tengo que calcular 2 volúmenes desconocidos.
El ejemplo dice se quieren preparar 30 litros de una solución de alcohol al 80% v/v a partir de 2 soluciones de alcohol una al 90% v/v y otra 75% v/v.
Agradeceré enormemente si ayuda.
Complicado Elvia, no lo habia visto asi.
Buenos Días, necesito si me puede aclarar este ejercicio por favor el cual no lo puedo resolver.
El vino es una solución al 12% P/V de alcohol en agua. La densidad del alcohol puro es 0,79g/cc ¿Cuál es el %P/V del alcohol en el vino?
Estaré atento a su respuesta, de antemano gracias.
Hola… Muy bueno tu post… hay algo que no pude encontrar, estoy haciendo un tp para el colegio y me piden que encuentre los ml de HCL que se necesitan para preparar 2L de una solución al 0,5 N partiendo de otra solución al 63 % m/m y una densidad igual a 1,2 gr/ml… Quisiera, por favor , si me pueden ayudar con esto… Desde ya Muchas Gracias
Gracias Nico pero ya no tengo tiempo de realizar ejercicios por aquí, imaginate que todos me pidan uno. Lo que te comento es que leas la teoría ahí he dejado ejemplos. Con el % ese y la densidad debes calcular la N del ácido. Después con la fórmula N1 x V1 = N2 x V2 sacas el volumen q te piden. La N que vos saques podría ser la N2 si queres. N1 = 0,5 N y V1 = 2 litros.
hola profesor, queria felicitarle y agradecerle, le juro que no sabia nada, muchas gracias por tan buena explicacion 😀 😀 bendiciones
Hola maestro, por favor ayuda con este problema, me fui a la B con el ejercicio. Era como física cuántica en chino. Le estaré muy agradecido.
se disuelve una muestra de 0,0560 g de ácido acético (COHECHE) en la cantidad suficiente de agua para preparar 50, 0 ml de disolución. Calcule las concentraciones de H+ el equilibrio. (Ka para el ácido acético = 1,8×10 elevado -5)
Camilo querido por cuestiones de tiempo se me hace difícil hacer ejercicios aquí.
como preparo 100 ml de una solucion de nitaro mde plata con una concentracion de 1%m/vol
Pesas 1 gramo de la sal y lo disolves hasta 100 ml de agua destilada.
Hola profesor necesito de su ayuda, no se como resolver esto. acaso me falta algún dato o asi como lo tengo puede resolverse? Calcular el % de soluto de una solución que tiene 20gr de sal disuelta en 200 ml . desde ya muchísimas gracias.
Hola es sencillo. 20 x 100 / 200 = ? no te olvides las unidades
sabe matematicas me puede decir cuales son los numeros mayores que 100 y menores que 200 divisibles por 9, 8 y 12 porfa ahora
Hola Andrea publicame este comentario en la sección de matemáticas por favor.
se desea conocer la cantisas de soluto para una solucion de H2SO4 =40% si el volumen final de la solucion es = 2,4L y la densidad de H2SO4 es igual 1,84 g/ml
Densidad es masa / volumen. Entonces calculas la masa primero. Masa = D x V
Masa = 1,84 g/ml x 2400 ml = 4416 grs.
Después entendemos que el soluto se encuentra en un 40% en la solución. Por lo tanto:
4416 grs x 0,40 = 1766.4 grs
hola tengo una pregunta me podrian ayudar en este problema
se hacen reaccionar 49g de NaOH con 200g de acido sulfurico diluido , si quedan sin reaccionar 9g de NaOH calcular la centracion en masa de acido sulfurico
La concentración del ácido? o la cantidad de la sal formada?.
Vos sos un pelotudo, mi hijo se sacó un 1 todo por ver tu página de porquería. Dedicate a otra cosa, no pudiste ayudar a un nene de 18 años a terminar 4to grado
Quien te crees que sos. Imbécil. Acá prestamos ayuda a todos los que la buscan y si no podemos se lo decimos. Este sitio es de los mejores, sino mirá los comentarios y no seas ciego. Tu hijo se saco un 1 seguramente porque es un vago y no estudia. Porque cuando alguien se preocupa, se saca un 4 o 5 pero no un 1. Capaz heredo tu vagancia. Que espera?, que le hagan ejercicios por internet?. No hay fórmulas mágicas señor Estupido. No voy a tolerar que irrespetuosos como vos nos hechen la culpa de sus fracasos a los que ayudamos a las personas.
Dos móviles se encuentran separados una distancia de 600 m. En un cierto
instante parten uno hacia el otro con velocidades de 40 m/s y 20 m/s.
Hallar el tiempo que demoran en encontrarse.
Hola Nilton por razones de tiempo se me hace cada vez más difícil contestar los problemas si no son preg específicas. Lee donde escribi de MRU problemas de encuentro ahí los explico. Soluciones químicas no tiene nada que ver
Quien sabe Que por favor me ayude el 6to punto
6. En el siguiente grafico aparece la variación de
solubilidad de dos cloruros en agua: de sodio (NaCl)
y de potasio (KCl)
file:///C:/Users/Usuario/Downloads/TALLER+SOLUBILIDAD002.pdf
A) Si se tienen dos soluciones saturadas de ambas
sales a 40 ºC de temperatura y se enfrían ¿Qué
sal precipita antes? ¿Por qué?
B) ¿y si la temperatura es de 20 ºC?
C) ¿Qué cantidad de cloruro de potasio podemos
añadir a una solución saturada a 40 ºC, si la
temperatura se aumenta hasta 80 ºC?
D) ¿A qué temperatura las dos soluciones tiene la
misma solubilidad?
Sin el gráfico no se puede Wendy
Me ayudas? 🙁
que peso de HCL quimicamente puro existe en 6l de solucion al 98% y 1,8 kg/l de densidad? :$
calcula la masa a partir de la densidad y el volumen de la solución. masa = d x v
masa = 1,8 kg/l x 6l = 10.8 kgs
después de esta masa el 98% es HCL puro. Así que calculamos la masa pura. 10,8 kgs x 0,98 = 10.584 kgs.
Por raones de tiempo no hacemos este tipo de problemas aquí espero te haya servido.
se disuelven 222g de hidroxido de calcio en 2 litros de agua ,me ayudas?
Y cual es la pregunta?
¿que volumen de agua se debe agregar a 200 cm cubicos de HNO3 6M(MOLES) para obtener una solucion resultante de 1,2N?
En el caso este la M es igual que la N porque es un ácido monoprótico (un H+).
M1 x V1 = M2 x V2
V2 = M1 x V1 / M2
V2 = 6M x 200 ml / 1.2 M = 1000
Como ya hay 200 ml agregándole 800 llegás a 1000 ml
hola ayudita xD
De que?
hola calcular la normalidad de la disolucion que se obtiene de diluir con agua 3,5 litros de acido sulfurico(H2SO4) 4M , hasta obtener el volumen final de 28 litros.
M = 4M x 3,5 litros / 28 litros = 0,5 M
En el caso de este ácido al ser diprótico(2 H). La N es el doble de la M
Asi que N = 1N
Buenas noches tengo dificultades con este ejercicio
Cual es la masa de Al(OH)3 que hay que disolver con suficiente agua hasta completar 500 ml de solucion con una concentración al 7% m/v
A ver. 7% m/v es 7 grs en 100 ml de solución. Si queres llevar a 500 ml usa más masa de ese soluto. O sea, 35 grs.
% m/v = masa / volumen x 100
masa = % m/v x volumen / 100
masa = 7 x 500 / 100 = 35 grs
Muy buen artículo, me ha parecido sencillo y he entendido un poco mejor el tema de concentraciones químicas, pero me quedo un pequeño inconveniente que puede alterar todo, cuando tenemos un soluto y un solvente en un problema, y nos piden hallar la solución, ¿debemos sumar o restar el soluto ? en la explicación del Vídeo dicen que hay que restar, pero en el articulo web dice que hay que sumar. Aclárenme eso por favor. Gracias
Hola y muchas gracias por tu comentario. Depende que buscas, si es para calcular la masa de la solución debes sumar las masas de soluto y solvente. Si es para sacar la masa de solvente restas la masa de solución menos la de soluto
b. Describir un producto utilizado en el hogar clasificado como coloide con sus Características generales y Propiedades.
– calcula el volumen de un gas que estando a 20°c se somete a 5°c y presenta un volumen de 2 litros
– 20 litro de un gas se someten a 10 atm de presion, si el volumen disminuye a 4 litros, cual sera su nueva presion?
– 200 ml de una solucion de densidad de 2 g/ml, se preparan con 0,25 g de soluto. calcule el % m/m
– cual es el volumen de una solucuion que 2 M contiene 120 g de NaOH disueltos en agua. (Na=23; O=16; H=1)
– 20 ml de acido puro se disuelven en 180 ml de agua, formando una solucion cual es el porcentaje v/v de la solucion.
me gusta su blog es muy practico me podria colaborar porfa con estos ejercicios con urgencia
Julian no resuelvo problemas extensos y menos que menos practicos enteros. Imaginate si a cada uno se lo tengo que resolver. Lee la teoría, para eso me tome el trabajo de hacerlo paso por paso.
Calcule la molalidad (m) de una solución que resulta de disolver 10 gramos de Al(OH)3 en 200 gramos de H2O.
Hace lo siguiente. Transforma los 10 grs de Al(OH)3 a moles después pasa los 200 grs de agua a kilos. Por último dividi los moles por los kgs. Eso te dará la molalidad. Repasa el concepto y te darás cuenta.
¿Que masa de soluto necesito para preparar 500 cm3 de scs al 10% m/v?
Al ser 10% m/v son 10 grs de soluto por 100 de solución asi que si necesitas 500 ml de solución, tendrás que tener 50 grs de soluto
necesito ayuda con este ejercicio
La etiqueta de una botella de 750 ml de un exquisito vino chianti® italiano indica “11,5 % de alcohol por volumen”. ¿Cuántos litros de alcohol contiene el vino?
En 100 ml de vino tenes 11,5 ml de alcohol puro. Por lo tanto en 750 ml de vino tendrás 750 ml x 11,5 ml / 100 ml = 86.25 ml o 0,086 litros.
hola gracias tu explicación m sirvió muchísimo pude entender todo…esto lo vi hace mucho y no m acordaba y mi hermana m pidió q la ayude pero no m acordaba la verdad gracias …mira q busq y busq y no encontraba lo q necesitaba hasta en youtuve y no lo entendí…pero lo tuyo m fue muy facial de entender gracias
Gracia María sos un amor.
en el ejercicio 6) Que volumen tendrá una solución al 5% m/v que contiene 80 grs. de soluto.
Por qué 1600 ml? me da 4 se supone que se reemplaza y quedaría:
5=(80/x)*100
5×80/100 = 4 D:
En qué estoy mal? Sé que no debería ser menos solvente 🙁
XD perdón!! ya entendí ajajajjajaja
No, despeja bien el volumen de la fórmula que di. % m/v = (masa soluto / volumen solución) x 100
V = (masa soluto / % m/v) x 100
Me puede ayudar con este ejercicio?
Se tiene dos soluciones acuosas de NHO3. La solucion A es del 50% m/m, densidad 1,08 g/cm3.
a. Cual es la molaridad de la solucion mas concentrada?
b. cual es la concentracion expresada en % m/v de la solucion mas diluida?
c. Indicar que masa de soluto hay que agregar a 50 cm3 de la solucion mas diluida para igualar.
Para mi en a. es 2M,puede ser? y en b. es 0,63 cm3. y no llegue al c.
Gracias!
que significa pendiente de moderacion?????
Seguramente es algun comentario la verdad nose a que te referís
No se puede resolver con esos datos. Aparte no resolvemos problemas extensos por razones de tiempo. Fijate en la teoría y entenderás como se hacen esa es la idea.
hola es la primera vez que comento aca,me podrias ayudar necesito para un trabajo saber porque uno necesita preparar una solucion
Porque la necesitas preparar?. Hay muchos casos en los que necesitamos preparar soluciones, por ejemplo para preparar un fármaco o algo en la cocina. Por ej la solución fisiológica es una solución muy importante en medicina
No Puedo Resolver Esto : Mg(2) el 2 Esta En Numeros Romanos ¡¡Ayuda!!
Es lo mismo, es la valencia del magnesio
Tengo una solucion con 249.9 gr nitrato de magnesio y 151.8 gr nitrato de potasio, aforada a 1 litro con agua y necesito saber el % peso/peso y porcentaje pero/volumen solo del Nitrogeno presente en la solución?
La densidad de la solucion es de 1.20 gr/ml
se puede calcular de alguna manera? ya lo intente pero no estoy segura que sea la manera correcta….
Determine la concentracion porcentual del nitrogeno de cada reactivo ( KNO3 y Mg(NO2)3 )
KNO3 N= 13.85%
Mg(NO2)3 N= 10.92%
Posteriormente calcule la cantidad de Nitrogeno en 249.9 gr de nitrato de magnesio
249.9 gr—–100%
X ———10.92%
X= 29.28 gr de nitrato de magnesio
calcule la cantidad de nitrogeno en 151.8 gr de nitrato de potasio
151.8 gr—–100%
X ——— 13.85%
X= 21.024 gr de nitrato de magnesio
lo siguiente que realice fue sumas las cantidades de nitrogeno puro 29.28 gr + 21.024 gr = 50.304 gr de N
entonce ya con esta cantidad aplique la formula de %P/V
%P/V= (50.304 gr / 1000 ml) X100 = 5.03 %
para sacar el porcenje peso/peso determine el peso total de la solcion por medio de la densidad y el volumen
m=densidad X volume
m=(1.20 gr/ml) x (1000 ml) = 1200 gr
entonces …
%P/P= (50.304 gr /1200gr) X 100 = 4.193%
Ésto fue lo que realice… pero no se si este en lo correcto…. espero pueda ayudarme ….. Muchas gracias!
No han respondido mi pregunta…. Ayudenme por favor…
que pregunta
Esta bastante bien. Estoy de acuerdo, veo que manejas bien el tema.
Muchisimas gracias por la atencion!! Saludos!!!
Besos Rubi, bendiciones
ayudamen una solucion contiene 10 g de sulfato de hierro es tratada con permanganato de potasio y acido sulfurico para completar la reacccion calcula el peso del sulfato de hierro obtenido
Esta mal ese enunciado.
por favor ayudame con esto, gracias de ante mano,
se mezclan 50cm cubico de acido sulfurico al 10% v/v con 80cm cubico del mismo acido al 6%v/v ¿determine la concentracion de la solucion resultante en %v/v. explimelo bien porfa estoy enredado.
Deberías calcular los volúmenes en ácido de las 2 soluciones. En la primera, 50 ml (al 10%) te dará 5 ml de ácido puro y en la segunda, 80 x 0.06 = 4,8 ml de ácido puro. Entonces suma los 2 volúmenes y te da 9.8 ml. En un volumen total de 130 ml ( 80 + 50 ).
(9.8 ml / 130 ml) x 100 = 7,54 % V/V
Hola me podrias ayudar en este ejercicio:se desea preparar 40ml de solución de hidroxido de sodio 0,2N.cuantos gramos de base sera necesario pesar?
0,2 normal es 0,2 M (molar) en el caso de los hidróxidos de un OH.
Moles = 0,2 M x 0,04 litros.
moles = 0,008 moles
lo pasas a masa
masa = 0,008 moles x 40 grs (PM)peso molecular
masa = 0,32 grs.
Hola! me podrías ayudar con este ejercicio?
Se necesita preparar 10 dcm3 de una solución de ácido ortofosforico 0,5M a partir de una solución de densidad: 1,605 g/cm3 , 65% m/m. Indicar
a) si la concentración de la solución de ácido ortofosforico es mayor, menor o igual a la de la solución 0,5M
b) el nombre de la operación a realizar para prepara la solución final
c)¿cuantos ml de solución (c) se gastan para realizarla? ¿como la realiza?
Hola, hice algunos ejemplos de esos en el post. Debes calcular la molaridad. Acá es medio complicado escribirlo. PM del PO4H3 = 98 grs
1,605 grs/cm3 x 1000 cm3/1 litro x 65 grs soluto/100 grs solución x 1 mol/98 grs soluto = 10.65 M
Obviamente es mayor a 0,5 M.
0,5 moles por litro o sea que para 10 litros necesitarás 5 moles. 5 moles son 480 grs. Entonces teniendo en cuenta el % de pureza pesarás:
480 grs x 100 / 65 = 738.46 grs
Hola, bueno me ha servido mucho su información pero me gustaría saber sobre el siguiente ejemplo:
Calcula el % m/m de una solución que tiene 10 grs. de soluto y 110 grs. de solvente.
Bueno el punto es que sumo 110+10 grs. pero lo que no entiendo es porque lo sumo?
Me encantaría que me respondiera hací podría terminar mi tarea
Se debe sumar soluto y solvente porque el % es sobre la solución. Entonces es 10 grs soluto / 120 grs solución x 100 = 8.33 % m/m
Hola que tal, me gusta mucho su información, pero realmente no entiendo como es que puedo deducir el procedimiento de estas soluciones. podría ayudarme con estas?
a. Disolución acuosa de hidróxido de sodio al 10% m/V (50 mL).
b. Disolución acuosa de etanol al 40% m/V (25 mL).
c. Disolución acuosa de etanol al 40% V/ V (25 mL).
d. Disolución acuosa de ácido clorhídrico al 10% V/ V (25 mL).
e. Disolución de fenolftaleína de 10 ppm (10 mL) (en etanol).
GRACIAS.
Hola Marisol. Cual es la pregunta? Solo veo datos. Por ej en la a) debes pesar 5 grs del soluto y disolverlo con agua hasta 50 ml. Allí tendrás 50 ml al 10%. Ya que e 10 % es para 100 y a vos te piden la mitad es decir, 50 ml entonces pesas la mitad del soluto.
Hola Marisol,
Yo creo que la «b» se acer más a lo que puedas buscar.
ventanas pvc baratas madrid precios y ofertas
Hola que tal, mi consulta es la siguiente:
una solución formada por 2 moles de ácido sulfuroso y 80 gramos de agua. Calcular: la normalidad y la molaridad. GRACIAS
Gaby querida escribí el post para que lean, entiendan y hagan sus problemas. Imaginate si tengo que contestar a todos los ejercicios no tenemos tiempo.
Falta como dato le volumen de la solución o de última la densidad. Ahora no quedara otra que tomar al agua como la única aportante de volumen, en ese caso, 80 grs son 80 ml o sea, 0,08 litros. Aplica las fórmulas y listo.
hola necesito ayuda para hoy mismo por favor ¡
problema :cuantos mililitros de alcohol se obtienen al pesar 455 gramos de alcohol teniendo en cuenta que su densidad es de 880 g/L
Lo siento recién lo veo hoy. Densidad = masa / volumen. Tenes D y m solo despejas el V. V = m/D. Después los litros los pasas a mililitros y listo multiplicandolo por 1000.
amigo espero me respondas si es hoy mejor xd. se mezclan 500 g de solucion de hcl al 20 porciento mm con densidad 1,8 g/ml con 25 g del mismo acido de 1,8 g/ml y 30 ml de agua ¿calcule la concentracion en porcentaje mm mv vv de la solucion resultante
Perdon Pedro pero no resolvemos problemas tan extensos por razones de tiempo, imaginate que cientos me preguntaran lo mismo a diario. Exitos en tus exámenes. Para eso publicamos los post con problemas resueltos. Leelos
ayuda porfa tengo un problema: cuantos gramos de soluto hay en 2 litros de solucion 15% m/v
El porcentaje te dice que en 100 mililitros de solución hay 15 grs de soluto. Entonces en 2000 ml (2 lts) habrán?.
2000 x 15 / 100 =
x favor quiero que me ayuden a resolver ejercicios de soluciones como :
20 gramos de NaCL están contenidos en 600 gramos de solucion .
indique la concentración en % en peso R= 3,33g%NaCL
hola una preguntaa una solución tiene una concentración 8% de masa sobre volumen ¿ cuanto soluto hay ? ¿cuanto solvente hay? que cantidad de soluto se necesita para preparar 260cm3 de solucion
otra pregunta mas – ¿Cuál es el porcentaje de volumen sobre volumen de una solución que esta conformada por 75cm3 de agua y 23cm3 de vinagre?
me darias explicaciones de ambas preguntas por favor Gracias Saludos.
(volumen de soluto/volumen de solución) x 100
(23/98) x 100
Si el dato es solo el % suponemos que el volumen total es de 100 ml. Asi que tenes 8 grs de soluto. 100 ml de solvente suponiendo que los 8 grs no ocupan casi volumen.
Si para 100 ml necesitas 8 grs para 260 necesitarás:
260 x 8 / 100 =
Buenas tardes, Tengo una consulta sobre un ejercicio que me dieron te lo copio a seguir » Se ha preparado una solución partiendo de 130 ml de agua a temperatura y presión normal y 20 gramos de cloruro de sodio. La densidad de la solución resultante es de 1,05g/ml. Exprese la concentración de la solución en %m/m %m/v; m y M » No logro entender ya que es la primera vez que veo este tema, desde ya muchas gracias.
Es largo Fede. Lee el post hay problemas de ese tipo. Te tiro el primero. masa de la solución es la suma de soluto y solvente, ahí lo explico bien.
% m/m = (20 grs / 150 grs) x 100 =
Hola Patricio mi nombre es Andreina soy licenciada en Quimica, excelente tu página para ayudar a los chicos a entender este mundo hermoso de la quimica, felicitaciones, muy pedagógica.
Hola Andreina. Es un verdadero placer colega. Tu opinión por demás autorizada me llena de elogios.
Hola, para mi es un placer encontrar una pagina como esta, ya que mi hija necesita ayuda con esta materia y sinceramente yo no se como ayudarla porque la química para mi es muy complicada…. le pidieron teoría y ejercicios de preparación y valoración de soluciones a partir de un soluto sólido y a partir de un soluto líquido…… les agradeceria mucho que pudieran ayudarla
Se mezclan 20 cm3 de solución 25% (m/v) de HCL con 40 cm3 de otra solución del miso soluto, al 10% (m/v). Hallar el % (m/v) de la solución resultante, suponiendo que los volúmenes son aditivos.
Me podría pasar el proceso de resolución, desde ya gracias.
Debes calcular la masa de cada solución. masa = (% x V) / 100
Después sumas las masas y ese resultado lo dividis por el volumen total. Lo multiplicas por 100 y listo.
Hola me podrías dar los paso a paso del ejercicio numero 10? te lo agradecería.
Esta explicado Gaby.
hola me puedes ayudar a resolver estos ejercicios xfavor : 1)cual es la concentracion de una solucion que se prepara con 30cm de sal y 40cm de agua
2) que cantida de solucion se puede preparar con 52g de soluto para que tenga 25%m/m
3)que cantida de soluto y solvente se necesita para preparar 250ml de solucion al 45%v/v
30 cm de sal o 30 grs?. cm no tiene sentido.
como se resuelve este ejercicio?:qué volumen de jugo de limón se necesitan para preparar una disolución de 2000 ml al 15%
por favooor
Para 100 ml usas 15 así que para 2000 ml? Es una regla de tres simple. Te invito a que lo termines ya esta avanzado.
Hola tengo examen mañana y no entendi el ejercicio numero tres, el de 1500 cm3 y 1,9 kg ayuda porfavor
No condice el número de ejercicio con los datos que pones.
Hola profe buenas noches me puedes ayudar por favor con este ejercicio
Preparar 500 mL de disolución de hidróxido de potasio (KOH) en agua al 9%m/v, suponiendo que la densidad de la disolución es prácticamente la del agua pura (1,0g/mL).
Muchas gracias
9 % m/v significa que necesitas 9 grs de soluto por 100 ml de solución en este caso el volumen te lo dara el agua. Asi que si queres 500 ml necesitarás 9 x 5 = 45 grs.
hola profesor, quisiera que me ayudara con este ejercicio:
¿que concentración N tiene una solución al 5% peso/volumen (5g/100ml) de NaCl?
Pasalo a molaridad y ese valor será el mismo que la normalidad ya que es una sal y el equivalente equivale a un mol.
Hola buenas tardes… Tengo el siguiente ejercicio y no lo puedo resolver ( Qué cantidad de agua debe agregar a 20 ml de solución de glucosa al 20% m/v para que quede con una concentración de 15% m/v?) Me podrá ayudar
Hola. Usa la fórmula C1 x V1 = C2 x V2 En donde C1 es 20% m/v C2 es 15% m/v V1 = 20 ml y V2 la debes averiguar. Te deberá dar mayor a V1 entonces la diferencia es la cantidad de agua que debes agregar.
yo tengo un problema con este:
se mezclan 20 ml de una solucion al 5% m/v, con 50 ml de otra solucion al 12% m/v, y todo esto con 50 ml de agua. calcule el % m/v de la nueva solucion.
como se hace lo necesito ya ayudenme
Hola es algo largo. V f = 20 + 50 + 50 = 120 ml
Calcula las masas de ambas soluciones. De la primera será 20 x 5 / 100 = 1 gramo.
50 x 12 / 100 = 6 grs
Suma las masas. 6 + 1 = 7 grs
Si tenes 7 grs y v final de 120 ml vos ahora calcula la nueva concentración de la solución final.
% m/v = (7 / 120) x 100 = 5.83 % m/v
Hola me puedes ayudar con el siguiente problema?? estaria muy agradecido por tu ayuda :
¿Cuál es la concentración molar y molal de agua en la niebla característica propia del bosque de niebla, si la solución de la condensación está formada por 25 g de CO2 y 25 cm3 de agua. ¿La concentración hallada es la esperada en este ecosistema?
GRACIAS…
No creo que sea aplicable en este caso la M ni la m
Hola me podria ayuda en un problema ..es la siguiente..
una solucion de H2SO4 contiene 33,33% del soluto y tiene una densidad de 1,25 g/cm3.
Nesecito expresar su concentracion en molalidad
A leer el post que explico ese tipo de ejercicios, para eso lo publique, no tengo tiempo para resolverle los problemas a todos perdoname. Lo que si te digo que la densidad no es necesaria con el otro dato suficiente. Debes calcular la masa del solvente restando a 100 grs la masa del soluto. Te dará unos 66,66 grs. Los 33,33 grs pasalo a moles con el PM del H2SO4.
33,33 grs x 1 mol/98 grs x 1000 / 66,66 = Resuelto
hola queria saber si me pueden ayudar con este problema…
a)Calcular el pH de una solucion 0.02N deKNO3, y luego COMPARARLA con una solucion 0.02M de NaF.
la constante del HF es : Khf=6,8×10 a la – 4. (no entiendo eso de comparar las soluciones)
b)¿cual es el proceso que sucede cuando estas sales se agregan a una solucion acuosa?
c) ¿existe alguna manera de calcular la extension en la que se realizan estas reacciones?.. en caso afirmativo realice el calculo correspondiente. ¿que significa el valor obtenido?
por que se le suman al porcentaje m/m ???
a que se le suman?
buenas tardes profe podria ayudarme con esto tengo q calcular el volumen de una solucion de koh ( M= 56,1) cuyo PH es 11,20 que contiene 0,250 gr de dicha base como puedo hacer ya pase el ph a poh y lo transforme a la mas a de oh pero estoy anulado a partir de ahi
Perdon Gaby pero por razones de tiempo no resolvemos problemas extensos
Buenas noches. Le agradeceria si me ayuda con una duda que tengo. Llevo tiempo tratando de resolver este ejercicio y no encuentro la forma:
La densidad de la solución de H2SO4 de una bateria de autos es 1225 g/mL y su molaridad es de 3.75 mol/L. Calcular % masa/masa.
Mi duda es posible calcular el % masa/masa solo con estos datos.
Gracias por su tiempo. Saludos!
Em un litro de solución tenes 3,75 moles o sea 98 grs de H2SO4. Según la densidad, un litro de esa solución tiene una masa de 1225 grs.
Si en 1225 grs de solución hay 98 grs de soluto en 100 habra?. Ya te lo hice ahora completalo vos.
hola quien me puede decir que es GS y
este la solucion de este problema gracias
a 500cm3 de una solucion acuosa de acido fosforico de GS= 1,25 y 38% de pureza se le añaden 250cm3 de agua ; determinar la moleridad de la nueva solucioon.
Tengo 13 años. Desafortunadamente , tengo Quimica en el colegio. Y la profesora nos dio tarea, claro que para cumplir esta, debo de leer un libro que no lo entiendo y no lo pienso releer.
Y bue, estoy buscando por internet las respuestas. Debo de completar un cuadro (qsy) y me pone:
«Soluciones—>segun la propiedad de soluto—->(Aca tengo 4 cuadritos para completar y no entiendo que es).
Pero cada vez que pongo eso por google me sale esta paguina, O sea que debe estar las respuesta aqui, pero igual no la encuentro.
Me podrian ayudar? Es para este viernes. (Hoy es miercoles).
Buenas noches Químico
Sera que me puedes hacer el favor de colaborarme con estos problemas.
1. Calcula la moralidad de una solucion que tiene 8 gramos de hidrixido de calcio en 1280 ml de solucion.
2. Cuantos gramos de pergamanato de potacio y agua, tendran 320 gramos de solucion con una concentracion de 6,4 % m/m.
Hola Jeronimo, necesitas entender el tema y para eso escribí el siguiente post con muchos problemas de ese tipo. Entra ya aquí:
http://www.quimicayalgomas.com/quimica-general/estequiometria-y-soluciones-quimicas/soluciones-quimicas/
BUENAS tardes
por favor ser que me pueden ayudar
–
–Cuantos gramos de pergamanato de potasio y agua, tendrán 320 gramos de solución con una concentración de 6,4 % m/m.
Buenas tardes, como hago para preparar una solución de ácido nítrico al 50% p/p y v/v, gracias
50 grs de ácido y 50 grs de agua. Lo mismo con el volumen.
Buenos dias tengo una duda si tengo una solucion que contiene 3 kg de hipoclorito granulado en 50 litros de agua, esta se agega a un tanque de 35.000 o un chiller por rebose y recirculando, segun el balance de materiales que concentracion en ppm tiene la solucion inicial y a que concentracio saldria el agua del chiller en ppm como cloro libre o residual.
me podrías ayudar con este problema?
una solución contiene 8% p/p de glucosa y densidad 1.03g/ml. determine su concentración en %p/v y %v/v.
gracias de antemano (PD: probablemente vuelva a hacerte otra consulta)
Francy ya no resuelvo problemas por fakta de tiempo, así que dejare publicada tu inquietud quizá alguien pueda.
Se tienen un hidróxido de sodio comercial con 60% de pureza.Si 90g de dicho hidróxido reaccionan con ácido clorhídrico puro ¿Cuántos g de cloruro de sodio se obtienen en una reacción con 85% de rendimiento real?
Con lo explicado en el post lo puedes resolver. Ya no hago más ejercicios contestados por razones de tiempo. Hace la reacción, equilibrala. Afecta la pureza y aplica el rendimiento a lo último.
hola ayudida ps ¿ cuantos moles de acetileno (C2H2) se produciran al tratar 8 gramos de carburo de calcio (CaC2), con suficiente agua? CaC2 +H2O flecha C2H2 +Ca(OH)2 (P.A :C=12 ;Ca=40; O=16
Sabes q por razones de tiempo no hago mas ejercicios. Si alguien lo resuelve mejor. Por eso lo publicare
Hola, tengo un examen y no se mucho que digamos
Me podrías ayudar, el examen es dentro de 8 horas, si lo pierdo no podre graduarme.
Brayan te hubieras preocupado antes y no 8 horas antes, no te parece?. Ofrecemos servicios de asesoría y preparación de trabajos prácticos, pero por favor con tiempo.
Brayan, deberías haberte preocupado varios días antes y no 8 horas antes, no te parece?. Ofrecemos servicios de asesoría y realización de trabajos prácticos, pero con tiempooooo.
Me gusta mucho la química aunque lo reconozco no soy buena pero igual gracias me ha despejado muchas dudas
quisiera saber como puedo resolver este ejercicio de disolución. una persona no puede conducir si la tasa de alcohol d sangre supera los 0,5 g/l . si una persona tiene 6 litros de sangre en su cuerpo ¿cuantos gramos de alcohol puede beber como máximo si tiene que conducir un vehículo?
0,5 x 6
hola, por favor quisiera que me ayudaras a resolver unos ejercicios:
que volumen de h2so4 de densidad 1,94gr/cc y 98 % en peso, es necesario para preparar 500 cc de solución a 0,5 normal.gracias.
Hola Eva ya no puedo resolver ejercicios aquí por razones de tiempo pero en el post he resuelto de este tipo. Fijate bien y leelos. Lo que debes hacer primero es calcular la N con la densidad y el % de pureza, luego usas la fórmula N1 x V1 = N2 x V2 y despejas V1 que sería el volúmen de la solución a la que le calcularás la N.
En el segundo punto, ¿por que sumas la cantidad de soluto y la cantidad de solución?, considero que ese ejercicio está mal y la gente que tal vez no sepa bien sobre estos temas se puede confundir, mi recomendación es que lo pongas bien, el resto esta muy bueno, Gracias por el aporte…
Ante todo Hola. Si te referís al segundo ejercicio. Dice bien claro que tenemos 10 grs de soluto y 110 grs de solvente (no solución), entonces es obvio que si necesitas la masa de la solución deberás sumar ambas masas, supongo que eso lo sabes. Entonces te da 120 grs de solución. Después aplicas la fórmula y ya. Quizá no lo leístas bien fijate. De todos modos te agradezco la observación, a veces me equivoco como todos y si descubro mi error trato de correjirlo. Pero este no es el caso, si te refería al segundo ejercicio como decís claro. Abrazo y leelo bien.
Por favor he estado practicando los ejercicios, tengo una duda en el ejercicio 2 de la práctica. Que masa AgOH se necesita para prepara 3 litros de una solución 0,4 M en este soluto. ¿ cuál es el soluto el de la pregunta uno? 30%v/v?.
La respuesta es 148.8 grs. Pero no se como llegar a ella,¿ que procedimiento debo segui?.Gracias.
El soluto es el AgOH. Con la M y el V calculas los moles moles = M x V y luego pasas esos moles a gramos y listo. No es difícil, tenes que leer la teoría.
aiudaaaaaa!
cuantos gramos de soluto se utilizará para preparar 300ml de una solucion al 8% de (NaCl)
– no estoy segura de mi respuesta 🙁
hola necesito ayuda con este ejercicio
Calcula el % m/v de una solución que tiene 54g de soluto en 457g de solución (densidad de la
solución = 0,86 g/ml)
Con los 457 grs y la densidad calculas el volumen de la solución. Después aplicas la fórmula de porcentaje y listo.
AYUDA!!! Si tengo una solución 0,75 molar de hidroxilo de magnesio y la densidad es 1,15 gr/ml. ¿Cual es el % m/m?
Hola. Primero tenemos 0,75 M osea que en un litro tenes 0,75 moles. Esta cantidad pasala a gramos. Después la milésima parte de esa camtidad estará en un mililitro. Compara esta masa que es la del soluto con la masa de la solución para el mismo volumen (1,15 gramos). Con esos dos datos calculas el % m/m. Abrazo.
me pueden ayudarcon el siguiente ejercicio :
calcula el volumen de una solucion al 12% de m / v donde se empleo 27 g de hcl
ayuda
Hola, me puede ayudar con el ejercicio numero 8? ¿Como calculo cuantos gramos de solvente tengo si el dato que da esta en ml?
No lo pide Flor. No te hagas problema. Si pediría algo así el enunciado debería tener más datos como la densidad.
Hola quería saber como se hacía el primer problema ese de sacar el % v/v con 1400 ml y 98 ml
Hola.Primero calcula el V del soluto. Restas 1400 ml de solución menos 980 ml de agua que es el solvente, entonces la resta te dará la cantidad en volumen de soluto. Después dividís ese V de soluto por el V de la solución y multiplicas por 100. Usas las fórmulas que explico en el post, leelo bien. Proba sino te da me decís.
Hola
Necesito una ayuda, el ejercicio me pide asi.
El precipitado de oxalato calcico procedente de 1,065gr de una caliza necesita para su valoración 40,25ml de una solución de KMnO4 0.2080 N.¿cuál es el porcentaje de óxido de calcio presente en ésta caliza?
Ya no hacemos ejercicios extensos Rubén por razones de tiempo. Lo publico igual por si alguien lo hace.
Buenas noches
‘Podria colaborarme en este ejercicio
Alrededor del 90% de las personas a la cuales se les analiza la sangre y mientras una concentración de alcohol en esta de 0.0030 g/ml evidencian signos de una intoxificacion etilica. La concentración fatal estimada es de 0.0070 g/ml ¿cual es el volumen de un ron de 80 grados (40% en volumen del etanol)que corresponde a la diferencia entre las dosis intoxificante y una dosis fatal para una persona cuyo volumen de sangre es de 7litros? asuma que todo el alcohol va directamente a la sangre. la densidad del etanol es o.80 g/ml
Perodna Julia ya no hacemos ejercicios extensos por razones de tiempo.
Hola!
Me puedes ayudar… necesito calcular la fracción molar de cada componente de una disolución de 184g de alcohol etílico(CH3CH2OH) y 162 g de agua
pasa las masas de gramos a moles y hace el cálculo como explico.
amigo me arias el favor de decirme como resolver una solución como esta.
calcular el %m/m %m/v %v/v de y me da 120 gra de sto y 15 ml solución 40 gra calcular
como puedo resolver una así
por que mi profesora no me queso esplicar como
Que significa 40 gra?. Eso no cierra.
Hola necesitaría quitarme una duda.
Tengo una disolución formada por 50g de dextrosa en 100ml de solución.
¿Cuántos ml de solución son necesarios para obtener 3g de dextrosa?
Gracias de antemano.
3g x 100 / 50 g = 6 ml
Hola me podrias ayudar con unas ecuaciones de Quimica por favor?
Hola. Necesitas clases?.
Hola me podrás por favor guiarme en este ejercicio: Calcular la molaridad y normalidad de la solución que contiene
d) 10g de H3PO4 en 40cm^3 de agua. Densidad de la solución 1,11g/cm^3
Te lo agradecería muchísimo.
Excelente blog!
Yanet. Fijate lo que explico en el artículo. Para M necesitas moles y volumen en litros. Asi que pasa a moles esos 10 grs y los 40 cm3 a litross. Después a esa M la multiplicas por 3 y te dará la N. Porque en un mol hay 3 equivalentes.
Hola, necesito ayuda con este ejercicio, por favor!
¿Cuántos gramos de soluto se necesitan para preparar 0.5 litros de una solución 1N de ácido fosfórico H3 PO4 ?
Despeja la cantidad de equivalentes de la fórmula de normalidad que explico en el post. Te dará 0.5 eq. Los pasas a gramos y ya.
alguien me puede ayudar por q no puedo entender como resolver masa en masa
Fijate los ejemplos. Es una forma de expresar la concentración. Por ej 3 % masa en masa (m/m) es 3 grs de soluto en 100 grs de solución
todavía no entiendo
hola por favor!!! ayudame con este ejercicio:
para obtener h2so4 55%m/m se usa el mismo acido al 28%m/m con 96%m/m del mismo. Cuanta masa del acido mas concentrado se tendra que agregar a cada 100kg del mas diluido?
por favorr mañana tengo el recuperatorio y literal, es el unico ejercicio que no me salio hasta ahora
Esta mal tu enunciado. O es al 28% m/m o es 96 % m/m.
Hola Patricio me podrias ayudar con este ejercicio
se debe preparar una solución de 5M de Al(OH)3 partiendo de un hidróxido de pureza 65%
cuanto soluto y solvente se debe pesar
es lo mismo preparar una solución 5N
Gracias
Sin la densidad esto será imposible.
Disculpa pero en los primeros ejs a mi me da de hacer (5% x320)/100 me da 0’16 no 16
Hola me dirías cual??
hola por favor me podrias ayudar con este ejercicio ?
un estudiante de bioanálisis ,mezcla un volumen de 125 ml de una solución de NaOH de concentración 1 mol/l con 150 ml de otra solución de NaOH 2 mol/l,luego diluyo con agua hasta 500 ml para que la solución final tuviera una concentración de 0,8 mol/l. calcule el volumen utilizado de agua para la dilución.
Hola. Yo sumaría los moles de las dos primeras soluciones y las dividiría por la suma de esos volúmenes en litros para que tengas el valor de la nueva molaridad al juntar las dos soluciones. moles es M x V así eue tendrás:
1 M x 0,125 litros + 2M x 0,150 litros = 0,425 moles
M = 0,425 moles / 0,275 litros = 1,545 Mhora le agregarás agua hasta que la M llegue a 0,8 M. Entonces usas la relación:
M1 x V1 = M2 x V2 En donde M1 es 1,545 M y V1 es 0,275 litros.
1,545 M x 0,275 lit = 0,8 M x V2
Despejas V2 y listo. Restas V2 – V1 y esa será la cantidad de agua que habrás agregado.
A
Me puedes ayudar en un problema porfavor?
¿Cuantos moles y cuantos equivalentes de soluto hay en 44 ml de una solucion de acido sulfurico a 2.28 M?
Entra de nuevo al artículo y a los videos que deje y vas a ver que lo vas a entender.
https://quimicayalgomas.com/quimica-general/estequiometria-y-soluciones-quimicas/soluciones-quimicas/
cual es la respuesta ??Calcula la normalidad de 10 gramos de Fe(OH)2 con una pureza del 90% en 250 mL de disolución.
Primero afecta el % de pureza a los 10 grs. 10 x 0.9 = 9 grs. Después pasa los a equivalentes y luego lo dividis por 0,25 litros.
Me ayudas con este?
Una solucion se preparo disolviendo en 75 ml de agua, 1,5 g de sal. Si la densidad resultó de 1,05 g/ml, calculá su concentracion en ambos porcentajes, g/l y en ppm
los 75 ml de agua son 75 grs en peso. Así que la masa de la solución es de 76,5 grs. Con la masa y la densidad calculas el volumen. V = masa/densidad. 76,5 grs/1,05 g/ml = 72,86 ml. Si querés calcular grs de soluto por litro de solución entonces dividis 1,5 grs de sal por 0,0728 litros.
Muchas Gracias! Pero en ppm como sería? porque no entiendo partes por millón!
Creo que ppm sería mg/litro no recuerdo bien.
Hola profesor, le hago una pregunta.
¿Cómo sacó la masa molecular del hidróxido de sodio? Porque me da 40g y no sé que es lo que hago mal. Quisiera que me aclare esa duda, muchas gracias por su aporte.
Suma las masas atómicas de lo átomo es tan fácil como eso. Da 40
hola buenas noches me puede ayudar ? dentro de poco tengo examen y mucho no entiendo de las soluciones .. mi profe nos dejo unos ejercicioos a resolver pero no se como resolverlo lo veo un poco dificil uno de los ejercicios son esto:
sabiendo que una solucion acuosa de 58g de NA, SO, en 700 ml solucion .
aº indique cual es el soluto y cual es el solvente .
bº calcule su concentracion en % p/v
cº señale cual es su normalidad
Hola Carla. La resolución de ejercicios tiene un costo.
Holaaa buenas noche me podria ayudar con un problema: Una solucion de acido sulfurico al 40% m/m tiene una densidad de 1.40g/cm3, determinar EL VOLUMEN DE SOLUCION QUE POSEE 70G DE SAL.
Me ayudarias porfavor es para mañana T_T gracias.
Hola me podrías ayudar con esta pregunta
Explique las diferentes formas en que se puede expresar la concentración de una solucion
Están respondidas en el artículo.
cuantos g. de ácido clorhídrico (HCl) necesitamos para que en 12100 ml de agua haya una solución de 25% en masa?
Se usa esta fórmula.
% m/m = (masa soluto/masa solución) x 100
12100 ml son 12100 grs en el caso del agua. Si llamamos x a la masa del soluto.
El tema es que solución es soluto más solvente. Así que en el denominador habrá que poner x + 12100 grs y en el numerador x. Así que despeja x.
Una pregunta % m/m de que vendria hacer de masa moralidad y este % m/v
No te entiendo
hola elquimico mee podrias ayudar en el ejersisio 4 se esta asiendo dificil entender si n mucha esplicacion y quiero saver lo paso a paso si tuvieras la gentileza
Cual ejercicio??
gracias querido por tanto apoyo y seguridad te deseo mucha suerte en la vida y mucha salud
Gracias muchacho.
disculpa tengo una duda, por ejemplo si me dan el valor de normalidad y me dan el valor de la densidad y me piden que saque mililitros; como le hago? gracias
Hola Alan. Deberías pasarme el enunciado.
hola puedes ayudarme
tengo que determinar la contencion %m/m de una solucion que se preparo disolviendo 36,8 g de sal comun (nacl) en 0,240 kg de agua?
son 240 grs de agua al pasar lo de unidad. Sumalo a la otra masa de soluto y te da 240 + 36,8 = 276,8 grs que es la masa de la solución. Entonces solo dividis la masa del soluto sobre la masa de la soución y lo multiplicas por 100.
Hola necesito comprobar la pureza de un reactivo que está al 96.15 % de curcumin que pesa 10kg como puedo comprobar que realmente ese reactivo tiene esa pureza ? Gracias por la ayuda que me puedas dar
Hola. No conozco esa sustancia.
Hola buenas tardes un favor tengo el siguiente problema:
A) cual es la normalidad del acido clorhidrico con densidad 1.19 gr/ml que contiene el 38.32% m/m de HCL
B) que normalidad tendra la solución si este ácido se diluye en relación 1:3?
_____ el inciso a) N= 12.67
——-el inciso b) no puedo calcular, no se como aplicar esa relación, ayuda por favor
Hola Andy. En el artículo pongo ejemplos de esos.
hola buenas noches, su correo sigue siendo [email protected]?? podria ayudarme con unos ejercicios por favor??
Hola erik si. Que necesitas.
Le envié un correo con algunos ejercicios que resolví en base a la información publicada y unos más que la verdad no entiendo podría apoyarme a revisar si están correctos y a explicarme los otros?? Son para examen extraordinario que presentaré el próximo martes, muchas gracias por su apoyo y por compartir sus conocimientos
No lo recibi.
cuantos moles hay en 50g de NaNO3
Hola primero. Dividis esa masa por el peso molecular y eso es todo.
una muestra de 0.892g de cloruro de potasio (KCI)se disuelve en 55.492 de solución
( porcentaje de masa)
Aplicas la fórmula que explique. Dividís la masa de soluto por la de la solución (55.492) y la multiplicas por 100.
hola me pueden ayudar a este problema? una maestra de 0.892g de cloruro de potasio (KCI) +se disuelve en 55.942 de solución?
y la pregunta? jajaja
Un ingeniero tiene un lote de 4500 kg de medicamento con 80% p/p de vitamina C, este debe contener
50% p/p según las especificaciones del medicamento, aparte tiene 500 kg de otro lote a 20% p/p de
vitamina C y mucho material sin vitamina C, este mezcla los dos primeros lotes y le agrega una cantidad
del material sin vitamina C tal que todo queda al 50%, Cuanta masa de este último debe agregar para que
todo el material tenga 50% de vitamina C?
profe ayúdeme porfa
Un ingeniero tiene un lote de 500 kg de un producto con 70% p/p de material activo, este debe contener
10% p/p según las especificaciones, aparte tiene mucha cantidad otro lote a 2% p/p del material activo,
Cuanto kilogramos del ultimo lote (2 % p/p) debe agregar a los 500 kg del primer lote para que quede
con las especificación?
hi
Hola.
que es el uso de las soluciones
Eso. Prepararlas para usarlas.
Un flujo de 185.5 lt/s de una mezcla de gases a una
temperatura de 400 ºK (45 atm) que contiene 60% gr/gr de CO2, 30% gr/gr de CO y 10% gr/gr de O2
densidad= 2.35 [gr/lt]
¿Cómo puedo sacar las concentraciones volumétricas de (CO2, CO, O2) con estos datos?
por mas que intento cosas no me da nada coherente :c
No realizamos ejercicios extensos por razones de tiempo. Si quieres consultar costos escríbenos al email.
Buenas noches necesito ayuda con estas dos preguntas por favor
¿Qué cantidad de agua se necesita para disolver 2465 gr de hidróxido de sodio en una solución de 56%m/m?
¿Cuál es la masa de soluto y solvente presente en 180 ml de solución ,que tiene una concentración de 80%m/m, y una densidad de 8 gr/ml?
Me puedes ayudar?
Me estan pidiendo que resuelva este ejercicio…
Se mezclaron 160 mililitros de alcohol en agua. Si la solucion resultó, ser 40% v/v. Que cantidad de solucion se preparo?
Hola María. Despeja el V de solución de la fórmula que explique. %V/V = V sto/V sción x 100
V Sc = V sto x 100 / % V/V
Se mezclan 20 gr de Aluminio puro con 100 ml de Ácido Clorhídrico 4 M para
producir tricloruro de Aluminio e hidrogeno gas. Cuando se termina el desprendimiento
de hidrogeno ¿Qué reactivo y en qué cantidad (expresando en unidades físicas) queda en
exceso? Valor
Hola Cinthya estos ejercicios extensos no los resolvemos por esta vía. Si necesitas clases de apoyo o TP escribinos al email.
Indique los gramos de Bromobenceno (C6H5 Br) que deben ser disueltos en 50grs de solvente cuyo peso molecular es 120grs/mol y su presión de vapor a 25C (grados centigrados) es de 70 mm Hg, si se requiere obtener una presion de vapor de 60 mm Hg,
Alguien puede ayudarme por favor
1) Se hallan disuelto 10 gramos de sulfato cúprico en 150 gramos de solución, calcule la concentración % m/m
2) A cierto volumen de agua, utilizado como solvente, se le agrega 35ml de alcohol, este queda completamente disuelto en el agua. Si la concentración de la solución es de 45%v/v, calcule la cantidad de agua que se utilizó en la solución.
Primero Hola. Segundo está fácil el 1) solo aplicas la fórmula. El 2) hay que pensarlo un poquito más. Pero se hace perfectamente con la fórmula. El 1) (10/150) x 100 (no puede ser más fácil)
se dispone de 37,5 cm3 de una solución concentrada de HCI cuya densidad es de 1,1980 g/cm3 ¿que volumen de solución al 6% m/v so/sn podría preparar? dígame maso menos como le puedo hacer para empezar a resolver ¿ para calcular el volumen tendría que dividir la masa por la densidad ?
Primero hola Luz. Definime concentrada?. Que porcentaje?. Sino no se puede hacer.