Hoy desarrollaremos los conceptos de reacciones reversibles e irreversibles. Sabemos que en toda reacción química tenemos a los reactivos que se unen para generar a los productos. Simbólicamente a la izquierda colocamos a los reactivos y a los productos en la derecha. No pensemos que siempre será más de un reactivo o producto. Podría tratarse de un reactivo y un producto. Cuando la reacción es irreversible, se formará producto sin quedar nada de reactivo. Son de reacciones unidireccionales y lo veremos con una flecha de un solo sentido hacia la derecha. Por el contrario, cuando son reacciones reversibles, siempre quedará algo de masa de reactivo y de producto. En las reversibles las velocidades hacia la derecha y hacia la izquierda son iguales. En este punto se establece un equilibrio químico. Pero debe entenderse como un equilibrio dinámico y no estático. Ambas reacciones siguen coexistiendo en ambos sentidos, pero sus velocidades se equilibran.
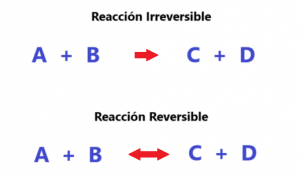
Desde el punto de vista del análisis químico las reacciones reversibles son más complejas. Una gran diferencia con respecto a las irreversibles es la presencia de la constante de equilibrio. Esta solo esta presenta en reacciones reversibles. Es una expresión matemática que relaciona las concentraciones molares de productos y reactivos. Todas las reacciones reversibles tienen un valor de K a cierta temperatura. Como toda constante, debe permanecer invariable ante los cambios que sufran algunas condiciones. La constante de equilibrio solo varía con la temperatura. Por ejemplo, cambios de la presión indudablemente afectará a las reacciones gaseosas o si aumentamos la concentración de un reactivo o un producto también se verá afectado transitoriamente dicho equilibrio hasta volver a retomarlo cumpliendo con el valor de la K. No queremos profundizar en este tema ya que el equilibrio químico merece más desarrollo. Solo queremos exponer aquí las diferencias entre las reacciones reversibles e irreversibles.
Para resumir, las reacciones irreversibles son unidireccionales. Solo van para el sentido de la formación de producto. Un ejemplo son las reacciones de combustión. Las reversibles mantienen un equilibrio entre formación de productos y reactivos. Obviamente no es 50 y 50. Podemos encontrar muchísimo más de uno sobre el otro, pero siempre coexisten ambos (productos y reactivos). El concepto de equilibrio no existe en las reacciones irreversibles. Como ejemplo de reacción reversible podemos citar a la formación de amoníaco.
N2 + 3 H2 <—> 2 NH3
Espero que te haya sido útil este material. Podes dejar tus comentarios o inquietudes. Podes ver mucho más contenido en mi sitio en la Categoría Química General. www.quimicayalgomas.com
Bioquímico y Profesor: Patricio Arroyo