GASES:
Los gases constituyen un estado de la materia que se caracteriza por estar formado por moléculas en las que predominan ampliamente las fuerzas de repulsión sobre las de atracción. Esto hace que tengan una gran expansibilidad y que ocupen todo el volumen en el que se contienen. Particularmente en los cursos de química se trata sobre los gases ideales. Estos gases no existen en la realidad, sino que son producto de simplificaciones basadas en suposiciones. Por ejemplo, en los gases reales las moléculas ocupan un volumen. Pero en los ideales se desprecia. Existen algunos gases teóricos como el gas de Van der Waals que tiene en cuenta en su fórmula al volumen de las moléculas y la fuerza de repulsión o atracción. Son gases que se acercan a los reales. Aquí trataremos sobre los gases ideales.
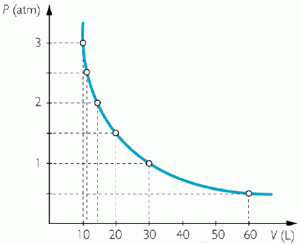
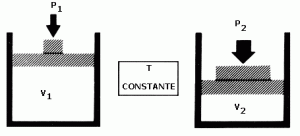
Una de las leyes más estudiadas en este campo, es la ley de Boyle Mariotte. Existen en los gases 3 parámetros que se estudian siempre y que representan variables, es decir que varían. Son la presión, el volumen y la temperatura. Este científico mantuvo constante la temperatura e hizo variar a la presión y al volumen y escribió los datos de ambos. Luego de tener varios valores, realizo el cálculo de los productos de V (volumen) y P (presión). Noto que cada P por su V daba siempre lo mismo, o sea una constante.
P1 x V1 = P2 x V2 = P3 x V3 = P4 x V4 = Pn x Vn
La forma del gráfico es de tipo hiperbólico.
Otros científicos como Charles y Gay Lussac probaron otras variaciones. Charles, mantuvo la presión constante. De esta manera variaban T (temperatura) y V (volumen). Estas magnitudes eran directamente proporcionales al contrario que en el experimento de Boyle. A medida que aumentaba T también lo hacía V. En este caso matemáticamente la constante estaba dada por los cocientes entre V y T.
V1/T1 = V2/T2 = V3/T3 = Vn/Tn
Gay Lussac mantuvo constante a V, de manera que observo que P (presión) y T (temperatura) se mantenían también directamente proporcionales. Cuando subía una también subía la otra.
P1/T1 = P2/T2 = P3/T3 = Pn/Tn
Estas 3 leyes se pueden resumir en una general:
Esta constituye la llamada ecuación de estado de un gas ideal. Permite calcular variable cuando 2 de ellas se han modificado.
Es conveniente mencionar el nombre de algunos procesos que se dan habitualmente:
Isotérmico: Es la transformación que se da a temperatura constante. Solo varían los parámetros de V y P. Es el caso de la transformación de Boyle Mariotte.
Isobárico: Es el proceso que se da a presión constante. Varían V y T.
Isocórico: Es el proceso que se da a volumen constante. Varían P y T.
Otra ecuación fundamental para los gases es la ecuación general de los gases.
P.V = n . R . T
El producto de la presión y le volumen es igual al producto entre el numero de moles la constante universal de los gases (R) y la temperatura absoluta del gas en Kelvin.
El valor de R es 0.082 atmosfera.litro/°K.Mol
Esta ecuación es muy útil a la hora de calcular moles o masas relacionadas con los tres parámetros de los gases (P,V y T).
Ha sido adaptada obteniéndose a partir de esta otra como: P.V = (sabemos que n es igual a masa/PM). P . PM = D . R. T Donde D es la densidad del gas. Masa/V es igual a densidad de ahí sale la relación. Ley de Dalton
Dalton estableció una ley donde se relacionan las presiones parciales de los gases con su fracción molar. Dice que cuando tenemos una mezcla de gases, la presión total de esta mezcla es igual a la suma de las presiones parciales de cada gas componente de dicha mezcla.
Pt = Pa + Pb +.…..+Pn Y la presión parcial de cada gas es igual a su fracción molar multiplicada por su presión total.
Pa = Pt . Xa
Ejercicios de Gases ideales
1 – Calcula el nuevo volumen de una masa de gas de 2 litros a la que se le aumento la presión de 1 atmosfera a 1.6 atmosferas en un proceso isotérmico.
Al ser la transformación isotérmica la temperatura se mantuvo constante. De manera que podemos obviar a la T de la ecuación de estado de los gases, quedando:
P1 . V1 = P2 . V2
Es decir responde a la ley de Boyle Mariotte: Aquí debemos despejar a V2
V2 = P1 . V1 / P2
V2 = 1 atm. 2 lts. / 1.6 atm = 1.25 lts.
2 – Calcula la temperatura final de un gas que se encuentra en un recipiente cerrado, cuya presión cambio de 3 a 5 atmosferas si su temperatura inicial fue de 24°C.
Siempre es conveniente pasar las temperaturas a la escala kelvin ya que no se pueden poner valores negativos en las fórmulas. Los 24 °C quedan como 297°K.
Aquí podemos ver que el volumen es constante. Ya que esta en el interior de un recipiente. Entonces la fórmula usada será:
P1 / T1 = P2 / T2
Calculamos la T2:
T2 = P2 . T1 / P1
T2 = 5 atm. 297 °K / 3 atm. T2 = 495 °K
3 – Que volumen ocuparan 2 moles de un gas que se encuentra a 280°K y 2.4 atm de presión?.
La fórmula usada en este caso es P.V = n.R.T
Despejamos V quedando:
V = n.R.T/P V = V = 19.13 lts.
4 – Cuantos gramos de oxigeno habrán en un recipiente si 1.2 litros generan una presión igual a 2,8 atmosferas a una temperatura de 78°C?. PM oxigeno = 32.
La formula usada será: P . V = m.R.T/PM
Despejamos masa:
Masa = P.V.PM/R.T
Masa = 3.736 grs.
5 – Calcula la presión parcial del gas A, si se mezclan 2 moles de A, 3 moles de B y 5 moles de C generando una presión total de 3 atmosferas.
En este caso hay que determinar la fracción molar de A.
XA = moles de A/ moles totales
XA = 2moles/10 moles = 1/5
PA = PT . XA = 3 atm . 1/5 = 0.6 atm.
Si queremos saber las presiones parciales de los demás gases hacemos el mismo procedimiento.
6 – Qué presión total se generara en un recipiente de 5 lts. si colocamos 2 moles de hidrogeno, 1 mol de oxigeno y 5 moles de nitrógeno a 273 K.
Estos gases si bien son reales supondremos que se comportaran como ideales, por lo tanto vamos a usar la formula general de los gases:
P.V = n . R . T
En este caso n será la suma total de todos los moles de los gases. Es decir n=8.
P = n.R.T/V
P = 35.82 atmosferas.
7 – Se tienen 2 balones de distintos volúmenes, separados y conectados por una llave cerrada.
En un balón de volumen igual a 2 litros tenemos nitrógeno a una temperatura de 25°C y 3 atmosferas de presión y en el otro de 3 litros, oxigeno a la misma temperatura y a 1.6 atmosferas presión. Calcula la presión final de todo el sistema después de abrir la llave.
En este caso al abrir la llave que conecta a los balones, los gases difundirán por ambos balones como si hubiera un solo recipiente. De hecho as así.
Primero debemos calcular la cantidad de moles (n) de cada gas en cada balón. Luego sumarlos (n total), y finalmente aplicamos la ecuación general de los gases y despejamos a la presión total.
Para al oxigeno tenemos:
Numero moles O2 = P.V/R.T
Moles de O2 = (1,6atm . 3 lts)/(0,082 atm l/Kmol . 298 K)
Moles O2 = 0.20 moles
De la misma manera calculamos los moles de Nitrógeno.
Numero moles N2 = 0.25 moles
Sumando ambas cantidades tenemos 0.45 moles totales.
Pt = n.R.T/V
Pt =(0,45 moles . 0,082 atm l / K mol . 298K) / 5 lts
Pt = 2,2 atm.
8 – que volumen ocuparan 3 grs. de oxígeno si a una temperatura de 25°C y 1 atm de presión.
Primero calculamos la densidad
P.PM = D.R.T
D = P.PM / R.T
D = (1 atm . 32 grs / mol) / (0,082 atm l / K mol . 298 K)
D = 1.31 grs./lt
D = masa/ volumen
V = masa/D
V = 3grs./1.31 grs/lt = 2.3 litros.
No te pierdas el video explicativo de Gases Ideales.
Me encuentro interesado en la producción de hidrógeno como energía, pero en los ensayos encontramos que se necesita mayor cantidad de energía aportada que la buscada, por ello buscamos una formula de equilibrio o un elemento que genere esa energía gratis que tanto necesitamos los humanos. Invocamos a las personas que tengan conocimiento y que puedan aportar para la liberación de la energía. Gracias
se necesita poliocteno de mercurio es muy bueno es caro pero yo lo consigoa a bajo precio
1MILIGRAMO DE CO2 A CUANTOS MILILITROS CORRESPONDE
ME SIRVE POR EL CALCULO DEL CALOR DE RESPIACIÓN DE LAS FLORES CORDIALE SALUDOS ELLERO GORI
Necesitamos el dato de la densidad sino imposible
Hola me puedes ayudar con unos ejercicio de QUIMICA sobre los gases ideales.? Espero tu pronta respuesta por favor.
Hola no tengo mucho tiempo pero pasame algun problema y te oriento
yo tengo el siguiente problema: 0.2032g de CaC2 por hidrolisis permite recoger 18.5mL de gas acetileno a una temperatura de 35ºC y una precion de 3.95 Atm . calcular el porcentaje de la pureza del carburo de calcio en la muestra. espero tu respuesta gracias..,
Hola. Primero deberías tener la reacción para que podamos efectuar los cálculos correspondientes.
Hola estoy atorado en un problema, me pide la diferencia de densidades entre nitrógeno gaseoso a 400atm de presión contra nitrógeno líquido en las mismas condiciones. Tengo la densidad del nitrógeno líquido en 800kg/m3. Tengo la temperatura del nitrógeno líquido pero de ahí no paso. Ayuda, gracias
Nosé tendría que leer el enunciado. Pero podrías fijarte en las tablas de densidades para ver los valores.
Hola buenas tardes saludos tengo un problema ya que estoy efectuando una investigación de adsorcion de sulfuro de hidrogeno (H2S) con un producto comercial de nombre triazina realice unas pruebas de laboratorio y la concentracion m redujo de 2000ppm de la concentracion inicial a 100ppm y solo utilice 2,5ml de triazina como hago para calcular la concentracion para llevar a 0ppm de (H2S).
Se tiene en cuenta que la triazina no es totalmente concentrada gracias y espero tu respuesta es urgente..
Hola, desconozco el producto. Por lo visti es bueno, éxitos
Por favor si pudieran ayudarme a responder este ejercicio se los agradecería mucho por favor.
Se tiene una mezcla gaseosa constituida por 25% en masa de O2 y 75% por N2, la cual fue recogida sobre agua a 19°C. La presión medida de la mezcla fue de 750 mmHg, si la presión de vapor de agua a 19°C es de 16.47mmHg. ¿ que volumen de la masa contiene 5 gramos de O2?
Buenas tardes.
Si eres bioquímico se supone que sabes escribir correctamente. Por favor revisa tus notas. Te pongo un ejemplo:
Cuantos gramos de oxigeno habrán en un recipiente si 1.2 litros generan una presión igual a 2,8 atmosferas a una temperatura de 78°C?.
Sería así:
¿Cuántos gramos de oxígeno habrá en un recipiente si 1.2 litros generan una presión igual a 2,8 atmósferas a una temperatura de 78°C?
Jajajaja por unos acentos?. Muy pobre tu aporte más allá de alguna razón por ortografía. Dijistes bien, soy Bioquímico no profesor de letras.
excelente explicacion pero si me dan un recipiente de volumen V contiene una muestra de 20.1 g de un gas desconocido a 20°C y 371 torr. despues de añadir 2,48 g helio al mismo recipiente a temperatura constante, la presion total es de 937 torr. calcular el volumen total? como haria en este caso porque tengo dos condiciones una final y una inicial lo que no se es como encontrar los moles del gas desconocido? espero me pueda ayudar muchas gracias
Hola Yoma. Yo creo que todo lo tenes que hacer ne base al helio ya que tenes os datos para hacerlo. La presión que ejerce el helio es 937 torr – 371 torr = 566 torr.
P.V = n.R.T n (helio) = masa / PM
Despejas el V y ya.
Me pueden ayudar con esto??
Suponga que la temperatura y la cantidad de gas permanecen constantes
A) v= 55mL a 190torr; ? A 1.0 atm
No le entiendo agradeceria su pronta respuesta
Y la pregunta?? jajaja, pone el enunciado
Se tiene 50 dm3 de Cl2 en C.N.P.T, se desea saber, ¿cuantos moles y que masa de cloro hay?
Te agradecería mucho si me ayudaras✌
De la fórmula P.V = n.R.T despejas los moles (n) y ya esta. Los datos los tenes todos. V = 50 litros, P = 1 atmósfera y T = 273 °K. R es la constante universal el valor lo debes saber.
Hola yo tengo un problema que no se resolver.
Un gas de 18 c y 759 mmHg ocupa un volumen de 150 cm3. Cual será su volumen a 65 c si se mantiene constante la presión?
Que formula tengo que usar
Hola, si mantenes constante la presión, te queda de la ecuación de estado P1 x V1 / T1 = P2 x V2 / T2
V1 / T1 = V2 / T2
Reemplazas y despejas. Y me decís como te salio.
Me falta un dato igual por que yo tengo t=18c p=759mmhg. V=150cm3. Y. T=65c. No se cual es el otro dato q m falta para esa ecuación. Gracias
Gracias ahí entendí lo que tenia q hacer gracias
Pero me faltan 1datos por que tengo t= 18 c p= 759mmhg. v= 150 cm3 t2= 65 c y m falta uno o como seria el q me falta
hola urgente me pueden ayudar con este problema no loentiendo 🙁
¿Se ha preguntado alguna vez cuál es la presión dentro de
un tubo de televisor?. Estime la presión (en atmósferas),
sabiendo que el volumen del tubo es de 5,0 litros, su
temperatura es de 23°C y contiene 0,010 mg de N2.
Tengo 3 ejercicio y no los puedo hacer alguien sabe como son para mañana 🙁
Un recipiente cilíndrico posee un diámetro de 36 pulgadas y de altura 10 pies. Contiene 15 lbmol C1 y 25 de C2 a a 95 oF.
¿Cuántas libras masa existen en el recipiente?
¿Cuál es el porcentaje molar de cada componente?
¿Cuál es la presión en el cilindro en psig?
¿Cuál es la gravedad especifica de la mezcla?
Marys por razones de tiempo no resolvemos problemas extensos. Lo que puedes hacer es contratar el servicio de resolución de trabajos prácticos.
a [email protected]
Necesito la ayuda cn unas tareas de quimica xfavor.. se trata de estequiometria, gases y mas xfavor
Hola Rossio. Te mande mail pero no llego. Si brindo ese servicio pero obviamente tiene un costo. Decime que necesitas.