La definición de ácidos y bases ha ido modificándose con el tiempo. Al principio Arrhenius fue quien clasifico a los ácidos como aquellas sustancias que son capaces de liberar protones (H+) y a las bases como aquellas sustancias que pueden liberar iones OH–. Esta teoría tenía algunas limitaciones ya que algunas sustancias podían comportarse como bases sin tener en su molécula el ion OH–. Por ejemplo el NH3. Aparte para Arrhenius solo existía el medio acuoso y hoy es sabido que en medios distintos también existen reacciones ácido-base.
Brönsted y Lowry posteriormente propusieron otra teoría en la cual los ácidos y bases actúan como pares conjugados. Ácido es aquella sustancia capaz de aportar protones y base aquella sustancia capaz de captarlos. No tiene presente en su definición al ion OH–.
Simbólicamente:
AH + H2O —-> A– + H3O+
El AH es el ácido, (ácido 1) de su base conjugada A– (base 1) y el agua (base 2) es la base de su ácido conjugado H3O+ (ácido 2).
El pH, abreviatura de Potencial Hidrógeno, es un parámetro muy usado en química para medir el grado de acidez o alcalinidad de las sustancias. Esto tiene enorme importancia en muchos procesos tanto químicos como biológicos. Es un factor clave para que muchas reacciones se hagan o no. Por ejemplo en biología las enzimas responsables de reacciones bioquímicas tienen una actividad máxima bajo cierto rango de pH. Fuera de ese rango decae mucho su actividad catalítica. Nuestra sangre tiene un pH entre 7,35 y 7,45. Apenas fuera de ese rango están comprometidas nuestras funciones vitales. En los alimentos el pH es un marcador del buen o mal estado de este. Por lo expuesto el pH tiene enormes aplicaciones.
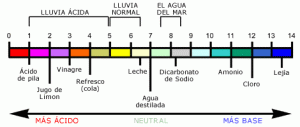
La escala del pH va desde 0 hasta 14. Los valores menores que 7 indican el rango de acidez y los mayores que 7 el de alcalinidad o basicidad. El valor 7 se considera neutro. Matemáticamente el pH es el logaritmo negativo de la concentración molar de los iones hidrogeno o protones (H+) o iones hidronio (H3O).
pH = -log [H+] o pH = -log [H3O]
Electrolitos fuertes y Débiles:
Son las sustancias que se descomponen en iones. Los fuertes se disocian o se separan en un 100% y los débiles en un muy pequeño porcentaje.
Al separarse en iones muchos de ellos pueden aportar iones OH– o iones H+ o H3O+ afectando al pH en cierta medida.
También hay un Potencial oxhidrilo (pOH) por haber iones OH–.
pOH = -log[OH–]
la suma entre el pOH y el pH nos da 14
pOH + pH = 14
Otra fórmula muy importante que vincula a los iones H+ y OH– es la Constante del producto iónico del agua.
Kw = [H+] . [OH–]
Kw = 1.10-14
Nos permite calcular uno de los iones cuando tenemos el otro ya que su producto siempre da 1.1014 en cualquier situación.
A veces nos piden calcular la concentración de iones OH– o H+ a partir de los valores de pOH y pH. En estos casos resultan muy convenientes estas formulas que no son ms que el despeje matemático de la fórmula de pH.
[H+] = 10 –pH
[OH–] = 10 –pOH
El pH y el pOH aparecen en ambos casos como exponentes.
Ahora que ya están expuestas todas las formulas primero veremos ejemplos con electrolitos fuertes, es decir, ácidos y bases fuertes.
Ácido Clorhídrico (HCl) 0,04M:
HCl —–> H+ + Cl–
En este caso la concentración molar de 0,04 M del ácido también será 0,04M del ion H+ y 0,04M de Cl–. De manera que el pH será:
pH = -log [0,04]
pH = 1,4
Hidróxido de Bario 0,06M (Ba(OH)2)
Ba(OH)2 ——> Ba+2 + 2 OH–
La concentración del ion OH– es el doble que la del Ba(OH)2 porque un mol del hidróxido genera dos moles de OH–.
Calculamos a continuación el pOH:
pOH = -log[0.12]
pOH = 0.92
pH + pOH = 14
pH = 14 – pOH
pH = 14 – 0.92
pH = 13.08
Electrolitos débiles:
En el caso de los electrolitos débiles, es más complicado calcular el pH y debemos recordar el concepto de equilibrio químico.
El equilibrio químico se aplica a las reacciones que son reversibles, es decir, que pueden ir en ambas direcciones. Pero aun así llega un momento en el que la velocidad de reacción hacia la derecha es igual que hacia la izquierda. En ese punto se establecen concentraciones de las sustancias que no varían en el tiempo y se puede aplicar la constante de equilibrio químico.
A + B <——–> C + D
K = [C] x [D] / [A] x [B]
Los electrolitos fuertes se caracterizan por ir en una sola dirección. En los ejemplos vistos anteriormente las sustancias se descomponen en iones y no hay reversa. En los electrolitos débiles veremos que la disociación iónica que va hacia la derecha puede tomar el camino opuesto y generar nuevamente la sustancia no ionizada.
Ejemplo:
Ácido acético (CH3COOH).
CH3COOH + H2O < ——- > CH3COO– + H3O+
Ka = [CH3COO-] x [H3O+] / [CH3COOH]
Calcula el pH de una solución 0.6M de ácido acético. Ka = 1,8.10-5
Para saber el pH tenemos que saber la concentración de [H3O+].
Al principio solo hay moléculas del ácido sin disociar. A esto se lo llama estado inicial.
CH3COOH + H2O <——-> CH3COO– + H3O+
Inicio 0.6M <———> 0 0
Al correr el tiempo se llega a un nuevo estado de equilibrio. Se formaran una cantidad x de moles de cada uno de los iones. Y esa misma cantidad de moles se consumirán del ácido.
CH3COOH + H2O < ———- > CH3COO– + H3O+
Equilibrio 0.6M – x <—-> x + x
Ahora utilizaremos nuevamente la constante de equilibrio pero usando las expresiones del equilibrio. Obtenemos asi la constante del ácido debil.
Ka = [X] . [X] / [0,6M – X]
Ka = [X]^2 / [0,6M – X]
1,8.10 ^-5 = [X]^2 / [0,6M – X]
Estamos en presencia de una ecuación cuadrática. Habrá que usar la fórmula de Baskara. Pero si hacemos una consideración no será necesario.
Como la cantidad de X será bastante pequeña en comparación con los 0.6M, podemos considerar a X = 0 sin entrar en grandes errores.
1,8.10^-5 = [X]^2 / 0,6 M
X = √ (1,8.10^-5 . 0,6M)
X = 3,286.10-3
pH = -log 3,286.10-3
pH = 2,48
Efecto del ión Común:
A continuación veremos que sucede cuando tenemos una mezcla de un ácido débil y una sal de su acido.
Antes debemos recordar el Principio de Le Chatelier. Este principio sostiene que cuando se introduce un cambio en un sistema en equilibrio, este responde de manera tal de contrarrestar a este cambio.
Si tenemos un ácido débil (AH) y una sal de este ácido por ejemplo NaA, estos se disociaran en agua.
AH + H2O <—–> A– + H3O+
NaA ——> Na+ + A–
Como vemos ambas generan al ion A–. Sabemos que el pH de una sustancia es el índice de la concentración de iones H3O+. Mientras mayor sea esta concentración menor será el pH. Según Le Chatelier, si aumenta el ion común A–, la reacción se desplazara hacia la izquierda. Esto reducirá la concentración de H3O+ e impedirá que el pH disminuya. A estas soluciones que tienen estas propiedades se las llama Buffer o Soluciones reguladoras o Soluciones Tampón. Están formadas por un ácido débil y una de sus sales o una base débil y una de sus sales.
Hay muchos sistemas buffer, incluso en nuestro organismo, para regular el pH de la sangre, que no soporta ni pequeñas fluctuaciones de pH.
Ahora veremos cómo calcular el pH en uno de éstos casos.
Recordemos la Ka del ácido:
Ka = [A-] . [H3O+] / [AH]
Despejando [H3O] resulta:
[H3O+] = Ka . [AH] / [A-]
Aplicando logaritmo en ambos miembros resulta:
– log [H3O+] = – log ( Ka . [AH] / [A-] )
– log [H3O+] = – log Ka + log ( [A-] / [AH] )
pH = pKa + log ( [A-] / [AH] )
La [A–] proviene de la disociación del ácido débil y de la sal. Pero la cantidad que aporta el ácido es muy baja comparada con la que aporta la disociación de la sal.
De la misma manera el ácido (AH) al ionizarse, algo de su cantidad es consumida. Pero es bastante poca comparada con la cantidad inicial de ácido.
Como casi todo el ion A– es proporcionado por la sal. La concentración de A– podemos reemplazarla por la sal en la fórmula. Tomando la siguiente expresión:
pH = pKa + log ( [Sal] / [Acido] )
Ejemplo:
Calcular el pH de una solución que contiene una concentración de un ácido débil de 0,3M y una concentración de su sal de 0,5M. El Ka = 1,8.10-5. pKa = 4,744
pH = 4,744 + log (0,5 M / 0,3 M)
pH = 4,744 + 0,222
pH = 4,97
Una observación que podemos hacer mirando la fórmula de Henderson Hasselbach es que si las concentraciones de ácido y sal son iguales el pH será igual al pKa. Ya que el logaritmo de un cociente que da 1 es cero.
Otra situación que se nos presenta en los problemas con las sales de electrolitos débiles es la reacción del anión del ácido con el agua. O el catión de la base débil con el agua si se trata de un hidróxido débil. A estas reacciones se las llama Hidrólisis, y a su constante de equilibrio, K de hidrólisis (Kh).
Ejemplo.
Calcula la [H3O] y el pH de una solución 1.10-3 M de la sal NaX. Ka = 1.10-8.
La reacción de hidrólisis es:
X– + H2O ——-> HX + OH–
kH = Kw / Ka
Kh = ( [H3O+] . [OH-] ) // ( [H3O+] . [X-]/[HX] )
Simplificando términos queda la siguiente expresión que responde a la reacción expuesta.
Kh = [HX] . [OH-] / [X-]
Podemos despejar de esta expresión a la [OH–].
Kh = 1.10^-14 / 1.10^-8
Kh = 1.10-6
Como la [HX] es igual a la [OH–]. El producto del numerador podemos expresarlo como X2. Y al despejar esta incógnita estamos averiguando la [OH–].
Kh = [X]^2 / [X-]
[OH-] = √ (Kh . [X-])
[OH-] = √ (1. 10^-6 . 1.10^-3)
[OH–] = 3,16.10-5
Con la Kw calculamos la [H3O+]:
[H3O+] = 1.10^-14 / 3.16.10^-5
[H3O+] = 3,16.10-10
pH = -log 3,16.10-10
pH = 9,5
también podemos calcular el pH a partir de la [OH–] que es 3,16.10-5.
De aquí calculamos el pOH.
pOH = 4,5
Por último sabiendo que la suma de pH y pOH da 14 tenemos:
pH = 14-4,5
pH = 9,5
Grado de Hidrólisis:
Es el porcentaje de hidrólisis de una sal en agua. Se calcula dividiendo a la cantidad de ácido formado por la concentración de la sal inicial.
Ejemplo:
Calcular el grado de hidrólisis de una solución de acetato de sodio (NaCH3COO) 0,1M. Ka = 1,8.10-5.
CH3COO– + H2O ——-> CH3COOH + OH–
[OH-] = √ (Kh . [CH3COO-])
[OH–] = 7,45.10-6
αh = [OH-] . 100 / [Sal]
αh = 7,45.10^-6 . 100 / 0,1 M
αh = 0,0074
Entra ya a nuestro video explicativo. Concepto de pH. Acidos y Bases Fuertes
Si tienes que realizar trabajos prácticos, necesitas resolver ejercicios para una prueba o examen, o quieres una clase particular, consulta precios al mail:
que con mucho gusto te atenderé.
Entra al siguiente video y enterate más sobre nuestros servicios.
Otros temas de Interés:
Neutralización ácido base
Equilibrio Químico
Gases Ideales
Compuestos Químicos y Nomenclatura
Cinética Química
Reglas de Solubilidad de los Compuestos
Hola Patricio, como andas? Esta genial tu pagina, no es comun encontrar paginas en internet que ofrezcan informacion seria y calificada, por asi decirlo.
Te queria hacer una consulta respecto al tema de pH… Al sufrir una dilucion una solucion de un acido fuerte el pH de la solucion aumenta en un grado, y con una solucion de base fuerte ocurre exactamente lo contrario, disminuyendo en un grado. Ahora, ¿que ocurre con el pH en una solucion de un acido debil y una base debil al diluirla? ¿Disminuiran y aumentaran tambien, pero no en un grado exacto?
Muchisimas gracias.
Me encanto tu pagina y tu buena predisposicion para hacer esto!
Un abrazo, Cecilia
Estudiante de la UNLZ- Fac. Cs. Agrarias.
Cecilia en realidad las diluciones afectan al ph pero afectara más a los fuertes que a los débiles. Ya que los débiles se ionizan mucho menos. El agua diluye los iones. Perdona por la demora
Hola Cecilia Respondiendo a tu pregunta sobre que ocurre con el pH en una solución de un ácido débil y una base débil al diluirla, es simplemente que el pH pasara a depender de cual de los dos predomina antes de la reacción debido a que la formula sera Kh= Kw/ (Ka x Kb) siendo:
Kh= constante de hidrólisis
Kw= constante del agua
Ka= constante del ácido
Kb = constante de la base
un concejo extra es que si en un ejercicio te dan la Ka o Kb asume que ese compuesto sera debil y si no te la dan asume que es fuerte, Saludos desde Chile, Estudiante Enfermería UNACH – Fac. CS. Salud .
Una informacion muy uril gracias
Para eso estamos. Cuando quieras te esperamos
una pregunta necesito hacer una monografía de ph, de qué fuente sacaste toda esta información? de alguna libro…así la incluyo en la bibliografía…gracias
La información la saque de mis conocimientos. Soy Bioquímico y Profesor, lo cual me avala para escribir bien y con garantía. Te paso mi nombre si quieres?. Necesitas mis datos?. Cualquier cosa hazmelo saber.
Hola Patricio…emmmm si me puedes ayudar en esto lo mas rapido posible,te lo agradezco.Tengo un proyecto de ciencias y me esta preguntando en una de estas preguntas que cual es la medida del pH neutro.Mi madre no entiende y las demas personas no me pueden explixar esto,si usted puede me ayudaria un monton.
Gracias~ =D
Lee el significado del pH. pH neutro es el que esta en 7. Pero lee ahí expongo el significado.
hola tengo un problema q no puedo resolver bien, capas podrías ayudarme, si quieres te lo planteo, gracias
Hola Martín dale mandamelo
Buenas noches. La profesora de química me dio el siguiente problema:
Calcular el PH de la siguiente solución: 20cm3 de una solución de HNO3, 20% m/v.
El problema es que pH me da negativo, y estoy haciendo todas las cuentas bien!
Debemos pasar el % m/v a molaridad. Los 20 gramos se llevan a moles. Se logra dividiendo por el PM del ácido nítrico que es 63 gramos. Después lo multilicamos por 10 para pasar de 100 cm3 a 1000 cm3 que es un litro. 20% / 63 x 10 = 3,17M lo cual generara un pH negativo. Decile a tu profe si te dio bien los datos. Generalmente en los problemas no deberían dar negativo
buenas noches. estoy haciendo un proyecto y ocupo hacer una cita y esperaba que me facilitara su nombre y tambien la fecha en que escribio esto. gracias
Hola mi nombre es Patricio Arroyo y soy bioquímico. La fecha del artículo debe salir alli mismo de todos modos te la dare. Es del 20/05/2011
muchas gracias por la informacion dada en el dia de hoy me sirbio mucho esta pagina es un elemento muy necesario para los estudiantes de hoy en dia
Gracias Steven. Difunde el sitio lo mas que puedas para que la información llegue a la mayoría
Hola patricio muy buena la pagina y sus contenidos excelentes,,mi consulta es si se puede calcular ph a partir de miliequivalentes,es algo que me tiene muy condundido ya que siempre lo hice a partir de concentracion de proton y moles de una sc.
Claro que si Beto pero tienes que pasarlo a molaridad.
Hola! Qué util… en serio que entendí más aquí que en clases… Sigue así, felicidades! 🙂
Gracias Maggie difunde nuestro sitio.Besos
hola solo quiero decirles que esto me ayudo mucho con mi tarea de quimica y se los recomiendo a todos los que les interesa la quimica este es un trabajo muy interesante y enverdad les puede servir de mucho para saber l,o que ustedes quieran saber sobre la qumica.bay,bay suerte con sus trabajos de quimica y kles deseo lo mejo y sigan a delante
Hola patricio me podrias proporcionar bien tu nombre,para citarte en un trabajo. gracias!
Hola Ivan. Patricio Andrés Arroyo. Bioquímico y profesor. Cuando gustes contactame. [email protected]
hola muy buena informacion!!! me sirvio de referencia para un trabajo de fisiologia solo una pregunta cuando fue la ultima fecha de actualizacion de esta info??? solo tiene el 20 de mayo pero no de que año
debe ser del año pasado seguramente
twngo dos problemas que no se como hacer si me podrian ayudar! por favor!
Ahi esta la teoria con eso deberias hacerlo tatiana
necesito saber que tipo de etiqueta es, manipulacion y almacenamiento, y los elementos de proteccion para los àcidos y bases
No es nuestra especialidad
como esta lo del libro?, me interesa, se compra o se descarga??
Hola. Se compra por cualquiera de los pagos mencionados. Una vez realizada la operacion te lo mandamos a tu mail y lo descargas de nmediato en formato pdf. Te aseguro que esta muy pero muy completo
Se compra, ahí ves las opciones, sino sos de Argentina hacelo por western union.
Se compra, una vez pagado te lo envío de inmediato, esta en formato electrónico
muy buena tu explicación muchas gracias!
De nada, para eso estamos Nadia
Muy buena explicación, pero tengo unas dudas. Por favor me contestaras lo más antes posible. Me dan una pregunta: Calcular el pH, pOH, [H+] Y [OH-] y la concentración del acido conjugado de una solucion de NaOH que resulta de mezclar 4 gramos NaOH con 25 ml de solución de NaOH 0,5 molar en suficiente agua hasta obtener 500 ml solución.
Me dan las respuestas, pero no se su desarrollo, he intentado pero no me sale. Me complico con lo de las mezlclas, si me podrias aclarar me ayudarias mucho.
Gracias.
Hola tenes q calcular primero todos los moles y dividirlos por 0,5 lts q es el volumen final. A los 4 grs pasalos a moles y aparte sumale los moles de la sulucion original, estamos?, la de 25 ml 0,5 molar. es 0,5M x 0,025 lts = 0,0125 moles. mas los moles de 4 grs de NaOH. 4/40 = 0,1 moles. Total = 0,1125 moles. Despues calculas la concentracion de OH q es facil por ser base fuerte q se disocia totalmente. Por ej si tenes 0,4 M sera 0,4 M de [OH] y de ahi seguis calculando todos los parametros como explico en el post.
hola muy buena la pagina pero me esta costando un poco el tema ph y poh.. mi ejercicio que no me sale dice asi..»calcula [H], [OH] y pH de una solucion formada por la mezcla de 25 ml de acido acetico 0,1 M con 35 ml de H2O. ka: 2×10-5.. como se resuelve este y ejercicios similares? gracias..
Bueno mira, no acostumbro a resolver ejercicios por aca ya que es muy extenso y se complica escribir formulas por aquí. Básicamente debes primero calcular la nueva molaridad del ácido ya que lo has diluido mas en agua. O sea que con la fórmula M1 x V1 = M2 x V2 lo puedes hacer. La M2 será: M2 = M1 x V1 / V2 = 0,1 M x 25 ml / 60 ml 0,04 M. Después empezas a usar este valor con la constante del ácido como explico en los ejercicios que habrás visto para el calculo de todo lo que piden.
Hola Carlos. Esta a un excelente precio teniendo en cuenta su contenido. Esta a unos 10 dolares.
muy bueno y fácilde entender!!!
buen dia exelente manera de explicar yo soy agronomo y entiendo el agua juega un papel importanticimo en la vida vejetal y animal , que papel juaga el agua en el hombre ya que segun me dicen puede se acida o alcalina , cual es mejor ?
es cierto que lo acido genera el desarrollo de celulas malas ?
Hola- Te aclaro que no hay agua acida o alcalina. El agua es la misma. Pasa que determinadas sustancias le cambian el ph. El caso de nosotros, bueno el ph depende de muuuchas cosas que no te puedo explicar aca. Pero la acidez no es buena para nada. Genera productos muy nocivos en el metabolismo y de ahí vienen enfermedades. Pero es muy largo el tema, no te lo puedo explicar aca. Desde ya gracias por lo q opinas de mi sitio. Cuando gustes tes esperamos.
Buen día, me gustó bastante la página, pero tengo una duda, me dejaron calcular el pH de un fármaco con pK=8 y definir cuántas moléculas se encuentra ionizadas y no ionizadas. De antemano muchas gracias, espero su pronta respuesta.
Hola Dani. Gracias pero para calcular el pH sería bueno saber mas detalles como concentración de esa sustancia, y la fórmula que es clave.
como podria plantera un marco teorico acerca del ph y porfavor una bibliografia plz es para un trabajo :c
No se exactamente que trabajo quieres hacer.
me parecio muy bien la información . detallada correctamente.
Gracias Rubi
soy estudiante de química de ciencias ambientales. mi pregunta es una pregunta de conceptos. Se me ha explicado cuales son las reacciones que se dan cuando un base o un ácido se disuelven en agua. mi pregunta es cómo puedo saber saber si una sustancia es ácida o básica para luego poder aplicar esas fórmulas teóricas. por ejemplo, se que el amoníaco es una base porque lo he estudiado, pero si no lo supiera como puedo deducir si se va a comportar como ácido o base?
podes medir el ph generado por esta al introducirla en el agua.
Oye Instructor en un PROBLEMA de PH = -log H + te dan el PH =1.6020 y te preguntan la Incognita la concentracion de iones hidrogeno,…como DESPEJAR -log…? H + = ?
Ahi lo explico. la concentración de hidrógeno (H+) es 10 a la menos ph
Porque existe un concepto de ph si simplemente es la concentración de iones H3O ?
Lo que pasa que es la forma más práctica de medirlo ya que queda una escala que va de 0 a 14. Sino quedarían numeros muy poco prácticos de manejar. Por ejemplo una concentración de iones hidrógeno de 1.10 a la menos 7 es mejor decir pH = 7.
excelente informacion del ph y la ecuacion para poder calcular el ph
Gracias Nadia.
hola entre en esta paginaa buscando que es acido y base esta es la informacion que busco
Esa es la idea me alegro por vos.
¡Buenas tardes Patricio! Soy estudiante de geografía de la UNAM, para citar tu trabajo en mis tareas escolares sería de gran utilidad que escribieras tu nombre con algún apellido y la fecha en que publicas tus entradas. Sin más por el momento, Recibe un cordial saludo.
Carlos querido, te paso mis datos.
Patricio Andrés Arroyo. Bioquímico y Profesor.
La fecha sale en los posts si no me equivoco
Que pasa con la sangre ácida,o con el cuerpo humano si su pH es menos 7,te puedes morir,si tu sangre marca 6,felicidades por tu respuesta.gracias
Hola. Claro que incompatible con la vida. El pH sanguíneo esta entre 7.35 y 7.45 alejandose de ese rango morimos
Hola! Tengo una pequeña duda. Me dejaron un problema en el que debo calcular el pH de la reacción HCN(pka de 9.14) y NaOH (pka de 14) si se disuleven 3.2 g del acido en 100ml. Concentracion NaOH: .1 molar.
El problema es que no se que debo considerar 🙁
Gracias
Hola mira tenes que escribir la reacción y balancearla. Después pensa que debes calcular las molaridades del ácido y de la base. Por lo que veo te darán 1,185 M del ácido. Supongo que la sabrás calcular con la masa del ácido y su volumen de 0,1 litro de dato. La del NaOH es 1 M. Entonces te sobrarán 0,185 M del ácido débil. De ahí sacas el pH como ácido débil. Creo que plantearlo así será más fácil.
Buenas noches! Gracias por la información, me sirvió muchisimo para poder enterder lo del pH. Mañana tengo prueba de merceología. Te felicito por tu manera de explicar! Saludos!
Gracias Ivana, me pone contento que te haya servido. Saludos.
Hola P. A. A., excelente este espacio que creaste, me dedico al buceo en Apnea, y estoy leyendo, investigando, recopilando información sobre que nos pasa fisiológicamente con esta práctica, tengo bastante información, peeeeero siempre falta algo más, y tiene que ver exactamente con la saturación de los distintos ácidos que generamos al retener el aire, y exponernos a exigencias físicas, podrás responder algo referido a este tema, desde ha muchísimas gracias.
Anibal querido, un placer
gracias encontre lo que queria saber
Me alegro Escarlen.
Hola soy un estudiante y quisiera saber si me puede ayudar con una pregunta que me dieron en un proyecto —> ¿Cual es electrolito o compuesto que le da el pH a la sangre?
He estado buscando la respuesta pero no la encuentro. Me podrias ayudar? Gracias 🙂
El pH de la sangre resulta de la suma de varias sustancias. Y son varios los sistemas buffer que lo regulan. Es la suma de los ácidos orgánicos generados en el metabolismo. Pero El buffer que reacciona más rápido es el pulmonar que relaciona las concentraciones de CO2 con bicarbonato. Se usa la ecuación de Henderson Haselbach para el cálculo de dicho pH. Entra aquí y verás algo mas ampliado.
http://www.scielo.org.mx/scielo.php?pid=S1665-19952014000200003&script=sci_arttext
gracias le ententi mejor que en claces felicidades
Que lindo Holga, besos.
y su apellido? lo necesito para citar.
Patricio Arroyo
Hola, quisiera saber si la definición del pH es la misma para la definición de la escala de pH.
Espero su pronta respuesta.Gracias.
Una cosa es el concepto otra es la escala
el químico buena información pero seria de gran ayuda si acostumbraras a a poner información que como tal ayude a referenciar. estoy desarrollando un informe de laboratorio del ph y necesito este contenido pero por falta de información no puedo añadirlo.
informacion que se requieren segun norma APA.
Como que info?.
hola xf soy estudiante sera q me puedes ayudar con un experimento trata del ph para saber como yo puedo determinar si es acidez o basisidad segun la escala y si no sabes el agua de repollo con agua salada que colos da es acidez o basisidad
Hola, Martin.
Por favor, quisiera saber por qué la escala de medición del pH es de 0 pH a 14 pH?
Verás, hay equipos que indican medir por encima y debajo de los valores máximos y mínimos de ésta escala.
Favor, tu ayuda.
Gracias
Hola Químico muy interesante tu trabajo ayuda bastante para no decir demasiado lo e leído bastante y visto tus videos no es mucho lo que logro entender ya que este no es mi campo es solo para saber (conocimiento general) Hablando de un papel ph marca macherey – nagel de 0 – 14 el papel tienen 4 columnas de colores , que significan o mejor dicho que químico busca cada columna , las respuestas que me han dado es la primero columna es acides , la segunda es alcalino pero desconocen las otras dos . espero tu respuesta y gracias por tomarte el tiempo en leer .
No lo conozco.
Hola necesito l ayuda de alguien para LA elaboraciòn de Una maqueta segun Los tipos de microorganismo??
Buen día.
Tengo una duda, utilice hidróxido de calcio puro con un pH de 8, después de 24 hrs disminuyó a 7 y se mantuvo, a los 30 días recupero el pH de 8. Debo mencionar que el hidróxido no interaccionó con ningún otro compuesto.
Gracias de antemano.
Saludos.
Es extraño. Hay que ver si cuando medistes 7 se midio bien.
Hola …. tengo una prueba importante en unos dias, mi profesor me dio algunas formulas para bases fuertes y debiles y acidos fuertes y debiles, pero sinceramente no las entiendo. No se si me podira ayudar con eso.
Disculpa la demora. He dejado videos al final del tutorial.
Hola Patricio, muy bueno tu artículo me llamo Albert muy bueno tu artículo, necesito ayuda:
me piden que realice las siguientes reacciones: Fe + HNO3 _= y Zn + H2SO4 = Ademas, decir que tipo de reacciones son y si alguno de los productos es nocivo. De ante mano gracias por todo
Hola Albert. Ambas son reacciones de desplazamiento de hidrógeno en estos casos. No veo nada nocivo.