EQUILIBRIO QUIMICO
Cuando estamos en presencia de una reacción química, los reactivos se combinan para formar productos a una determinada velocidad. Sin embargo, los productos también se combinan para formar reactivos. Es decir, la reacción toma el sentido inverso. Este doble sentido en las reacciones que es muy común en química, llega a un punto de equilibrio dinámico cuando ambas velocidades se igualan. No hablamos de un equilibrio estático en el que las moléculas cesan en su movimiento, sino que las sustancias siguen combinándose formando tanto productos como reactivos. A este equilibrio lo llamamos equilibrio químico.
El equilibrio químico se representa a través de una expresión matemática llamada constante de equilibrio.
En una reacción hipotética:
aA + bB <——–> cC + dD
La constante de equilibrio esta dado por:
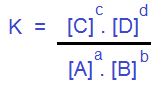
La constante de equilibrio químico es igual al producto de las concentraciones de los productos elevados a sus coeficientes estequiométricos (c y d) dividido por el producto de las concentraciones de los reactivos elevados a sus coeficientes estequiométricos (a y b). Recordemos que estos coeficientes son los números que equilibran a las reacciones químicas. La constante no varía, por eso es constante. Solo depende de la temperatura. A cada temperatura distinta habrá valores diferentes de constantes para la misma reacción. Con respecto a las unidades de K, estas dependerán de la expresión matemática que quede en cada caso particular.
Según el valor que tenga la K de equilibrio, tendremos una idea certera de lo completa que puede llegar a ser una reacción. Si estamos en presencia de una K grande, mucho mayor que 1, la reacción tiende a completarse bastante a favor de los productos. Caso contrario sucede si la K es muy pequeña.
En el caso de aquellas reacciones donde figuren compuestos en estado gaseoso, la constante se denomina Kp en lugar de Kc como normalmente se usa en las reacciones. Kp hace alusión a la presión en lugar de la concentración molar.
Kp = Kc.(R.T)∆ng
R = Constante universal de los gases.
T = Temperatura absoluta.
∆ng = Variación del numero de moles gaseosos.
Principio de Le Chatelier:
Cuando hablamos de equilibrio aplicado a sistemas químicos o físicos, siempre se hace hincapié en el Principio de Le Chatelier. Este principio sostiene que un sistema siempre reaccionará en contra del cambio inducido. Por ejemplo, si una reacción gaseosa aumenta el volumen al formar productos, al aplicarle una presión tendera a formar reactivos, es decir, invertirá su sentido con la finalidad de disminuir esa presión. Otro ejemplo lo tenemos en las reacciones exotérmicas o endotérmicas, las que generan calor o absorben respectivamente. Si a una reacción exotérmica le damos calor, el sistema para disminuir la temperatura, irá hacia la formación de reactivos. De esta manera generara menos calor para atenuar el cambio. Y si es endotérmica formara más productos, y así, absorberá más calor evitando el ascenso térmico.
Cociente de reacción (Q):
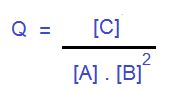
Volviendo al tema de la constante de equilibrio, ahora explicaremos el concepto de Cociente de reacción. Matemáticamente es igual a la expresión de K, pero el significado es diferente.
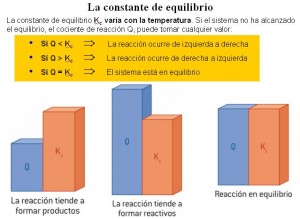
El valor de Q nos indicará hacia donde tendera la reacción, es decir, no se refiere al punto de equilibrio como la K ya que es calculada en un momento distinto al equilibrio. Ahora si calculando Q nos arroja el valor de K concluimos que la reacción se encuentra en el equilibrio.
Si Q es mayor que K, las concentraciones o presiones parciales de los productos son mucho mayores, entonces la reacción tiende a formar reactivos, es decir, hacia la derecha. Si Q es menor que K, la reacción ira hacia la derecha, es decir, hacia el sentido de la formación de los productos.
PROBLEMAS:
1. Según la siguiente reacción:
A + 2 B <———> C K = 45
Si tenemos en un comienzo de reacción 0,2 moles de A, 0,4 moles de B y 0,6 moles de C en un volumen de 4 litros. Averiguar hacia donde se direcciona la reacción.
Para esto debemos calcular el cociente de reacción (Qc):
Primero calculamos las molaridades de cada especie:
[C] = 0,6moles/4lts. = 0,15 M
[B] = 0,4moles/4lts. = 0,10 M
[A] = 0,2moles/4lts- = 0,05 M
Qc = 0,15 M / [0,05 M . (0,10 M)2]
Qc = 300
Concluimos que este valor es muy superior a la Kc. Por lo tanto la reacción tenderá fuertemente hacia la izquierda. O sea, hacia la foramación de los reactivos.
2. En una determinada reacción se mezclan concentraciones iguales de [HI], [H2] y [I2] = 0.03 M. La K a 783°C es de 46. Averiguar qué sentido tomara.
H2(g) + I2(g) <——–> 2 HI(g)
Qc = [IH] ² / ( [H2] . [I2] )
Qc = [0,03 M] ² / ( [0,03 M] . [0,03 M] ) = 1
Vemos que Q es mucho menor que K. Por lo tanto la reacción conducirá a la formación de productos.
3. Para la siguiente reacción:
H2(g) + Br2(g) <———> 2 HBr(g) Kc es 2,18.106
Averiguar las concentraciones molares de las tres especies en el equilibrio si partimos con una [HBr] de 0.4 M.
Debemos plantear la condición de inicio y de equilibrio para establecer los cambios y calcular las concentraciones de las distintas especies en el equilibrio.
Reacción: H2(g) + Br2(g) <———> 2 HBr(g)
Inicio 0 + 0 <———-> 0,4 M
Equilibrio x + x <———-> 0,4 – 2x
En el inicio las concentraciones de H2 y de Br2 son cero, porque aún no se han formado nada de estas especies. Pero a medida que transcurre el tiempo se generaran cantidades desconocidas de ambas a expensas de la concentración de HBr. Estas cantidades desconocidas llamadas “x” serán iguales entre si estequiometricamente ya que según la reacción, a partir de 2 moles de HBr se forman un mol de cada especie de la izquierda. Por esta misma razón en el equilibrio a la concentración de HBr habrá que restarle una cantidad “2x”.
Ahora con estas nuevas expresiones de equilibrio iremos a la expresión de la K de equilibrio para calcular la cantidad “x”.
K = [ 0,4 M – 2X ] ² / [X] ²
La resolución de esta ecuación es cuadrática. Despejamos X y desarrollamos el cuadrado de binomio que aparece en el numerador.
K.[X]2 = [0,4M – 2X] 2
K.[X]2 = (0,4) 2 + 2.(0,4).(-2X) + (-2X) 2
K.[X]2 = 0,16 – 1,6x + 4 X 2
2,18.106 X2 = 0,16 – 1,6x + 4 X 2
Reordenamos términos e igualamos a cero quedando una ecuación cuadrática. El termino 4 X 2 pasa a la izquierda para ser restado a 2,18.106 X 2. Obviamente es muy pequeño como para producirle una modificación. Por ende la ecuación quedara:
2,18.106 X2 + 1,6 X – 0,16 = 0
La resolución de esta ecuación de segundo grado nos da:
X1 = 2,7.10-4
X2 = – 2,7.10-4
Elegiremos al valor positivo ya que no existen concentraciones negativas. Por lo tanto las concentraciones de las especies son:
[Br2] = 2,7.10-4 M
[H2] = 2,7.10-4 M
[HBr] = 0,4 M – 2. (2,7.10-4 M)
[HBr] = 0,399 M
4. En un reactor con capacidad de 10 litros, se añadió 2000 g. de H2 y carbón solido. Después de cierto tiempo, al alcanzar el equilibrio se detecto que había 0,22 g. de metano. Calcular la Kc para la reacción.
C (s) + 2 H2 (g) ———> CH4 (g)
Este caso se trata de un equilibrio heterogéneo, ya que se encuentran dos estados de materia distintos, solido y gaseoso. Los sólidos no afectan al equilibrio, se los considera de molaridad igual a 1. Por lo tanto la Kc queda de la siguiente manera:
K = [ CH4] / [H2]²
Debemos pasar los 0,22 gramos de metano y los 2000 gramos de Hidrógeno a moles:
2000 grs . 1 mol/ 2 grs = 1000 moles H2
0,22 grs . 1 mol/ 16 grs = 0,0137 moles CH4
Ahora dividimos ambas cantidades por 10 litros.
[CH4] = 1,37.10-3 M
[H2] = 100 M
Kc = [ 1,37.10-3 M] / [ 100 M]²
Kc = 1,37.10-7 l/mol
5. Teniendo en cuenta la síntesis de amoniaco. Calcular las concentraciones de todas las especies en el equilibrio partiendo de una concentración inicial de NH3 de 0,5 M. K = 4,34.10-3 a 300°C
Reacción N2 + 3 H2 <———> 2 NH3
Inicio 0 + 0 <———-> 0,5 M
Equilibrio x + 3x <———> 0,5 M – 2x
Kc = [ NH3 ]² / [N2] . [H2]³
Kc = [ 0,5 – 2x ]² / x . (3x)³
Kc = [ 0,5 – 2x ]² / 27 x4
De aquí despejamos x y nos quedaremos con el valor positivo que haga posible las concentraciones.
6. Calcula la constante de equilibrio de la siguiente reacción teniendo en cuenta que se combinan 7.94 moles de hidrógeno con 5.30 moles de Iodo al principio. En el equilibrio se encuentra que hay 9.52 moles de Ioduro de hidrógeno.
H2 + I2 <——–> 2 HI
Para encontrar la constante de equilibrio debemos focalizarnos en el punto de equilibrio. Al inicio no hay nada de HI y en el equilibrio hay 9.52 moles. Esto significa que se consumió parte de los dos reactivos, que como marca la estequiometria son iguales en cantidad de moles. Llamando x a estas cantidades correspondería la cantidad de 2x para el HI. El problema tampoco nos dice el volumen del reactor. Pero no influirá para sacar la molaridad, ya que es el mismo para todas las especies. Por lo tanto podemos trabajar directamente en moles sin cometer errores en los resultados. Volvemos a plantear la reacción al inicio y en el estado de equilibrio:
Reacción: H2 + I2 <———> 2 HI
Inicio 7.94 mol + 5.30 mol <———> 0 mol
Equilibrio 7.94 – x + 5.30 – x <———> 2x
Como vemos 2x es una cantidad que ya tenemos, puesto que corresponde a los 9.52 moles formados en el equilibrio de HI. Por lo tanto x es igual a la mitad de esta cantidad.
X = 9.52/2 = 4.76 moles.
Keq = [(2x)² ] / [(7.94 – x) . (5.30 – x)]
Keq = (9.52) ² / [(7.94 – 4.76) . ( 5.30 – 4.76)]
Las unidades de moles se cancelan.
Keq = 52.78
A continuación daremos un ejemplo de otro tipo de equilibrio muy visto en los cursos de química. Cuando dos iones de distinta carga se asocian a veces pueden formar precipitados. Esta nueva sal tiene una constante de equilibrio llamada Kps (Constante del producto de solubilidad). Cuando este valor es superado para cada compuesto en particular se formará un precipitado. Cada sal o hidróxido que precipita, tiene su Kps propia y establecida generalmente a 25°C. En la expresión de los Kps solo figuran las concentraciones molares de cada ión en el numerador, no figurando nada en el denominador. Las concentraciones de cada ión tienen que estar en molaridad para establecer el Kps de cada compuesto.
Se mezcla 30 ml de una solución de Sulfato de Sodio 0,0100 M con 10 ml de Cloruro de Bario 0,0050 M. Calcular si se formará precipitado de Sulfato de Bario o no. Kps BaSO4 = 1.08 x 10-10.
La reacción del equilibrio de solubilidad para el Sulfato de Bario es:
BaSO4 ↔ Ba++ + SO4=
Sabemos que el Kps está dado por:
Kps = [Ba++] x [SO4=]
El Cloruro de Bario y el Sulfato de Sodio en solución acuosa aportan los siguientes iones:
BaCl2 → Ba++ + 2 Cl –
Na2SO4 → 2 Na+ + SO4=
Observamos que los iones Ba++ y SO4= justamente son los que se unirán para formar el supuesto precipitado de Sulfato de Bario. Sin embargo deberán alcanzar cierta concentración molar para que esto suceda, de lo contrario no se formará el precipitado.
Calcularemos las concentraciones de estos 2 iones una vez que se mezclen ambas soluciones.
Al mezclar ambas soluciones el volumen final será de 40 mililitros. Entonces debemos calcular las nuevas concentraciones de los iones Ba++ y SO4=.
Lo haremos con la fórmula M1 x V1 = M2 x V2
Para el Ba++: La molaridad de este ion será la misma que la de su sal ya que vemos que en la reacción 1 mol genera un ión de Ba++.
M1 = 0,0050 M, V1 = 10 ml y V2 = 40 ml.
M2 = M1 x V1 / V2
M2 = 0,0050M x 10 ml / 40 ml = 0,00125 M
Para el ion SO4=: La molaridad inicial de este ión será la misma que la de su sal ya que 1 mol de su sal genera 1 mol de este ión.
M1 = 0,0100M, V1 = 30 ml y V2 = 40 ml
M2 = M1 x V1 / V2
M2 = 0,0100M x 30 ml / 40 ml
M2 = 0,0075M
Ahora calcularemos el producto de solubilidad (Qps) en un punto como este, es decir, que no esta en el equilibrio (Kps).
Qps = [Ba++] x [SO4=]
Qps = 0,00125M x 0,0075M
Qps = 9,37 x 10 -6
Vemos que este producto es mucho mayor que el Kps (1,08 x 10-10). Por lo tanto, si aparecerá precipitado.
Otros temas de Interés:
Neutralización ácido base
Sistemas Materiales y métodos de Separación
Cinética Química
Gases Ideales
Propiedades Coligativas
Estructura atómica y Números cuánticos
Termoquímica y Termodinámica
la verdad que me gustaría que explicaras mejor, pero no dando valores imagina que estas en un laboratorio y no sabes nada y debes calcularlo todo como calcularías la constante del ácido sulfúrico, por ejemplo, por lo demás esta excelente te felicito
Hola. Tenes que leer bien la teoría que explico al principio. Si lees bien sabrás que el ácido sulfúrico es un ácido fuerte. Por lo tanto no tiene K de ionización o disociación porque justamente es un ácido fuerte. Lee la teoría primero. Gracias
Hola Químico, el ácido sulfúrico tiene dos hidrógenos, en la disociación del primer hidrógeno se comporta como ácido fuerte, pero en la disociación del segundo es débil y por lo tanto tiene constante de disociación.
Interesante, pero te aconsejo que revises antes de publicar.
En ningun momento hable del ácido sulfúrico. Podes leer el artículo acido base donde expongo específicamente el tema de ácidos y bases. Obviamente que tiene una segunda disociación. No hay ningun problema entonces.
¿Cómo que no hablaste del ácido sulfúrico?
TU: Hola. Tenes que leer bien la teoría que explico al principio. Si lees bien sabrás que el ácido sulfúrico es un ácido fuerte. Por lo tanto no tiene K de ionización o disociación porque justamente es un ácido fuerte. Lee la teoría primero. Gracias
Ahí claramente afirmas que el ácido sulfúrico no tiene K de disociación y abajo dices que no hablas de él, confiable tu sitio…
Es un acido fuerte. Lee la teoría y verás que se disocian al 100% por eso no tienen K de disociación. Debes ir al otro art´culo que habla de ello en ácdos y bases ph.
Favor de poner sus apellidos, lo quiero citar en un trabajo universitario y no puedo solamente con su nombre, gracias.
Patricio Andrés Arroyo. Bioquímico y Profesor
Químico: en el problema nº5 entiendo que conduce a la solución de una ecuación completa de cuarto grado,(en primer lugar), pues x está elevado a la uno en el primer sumando y como el segundo sumando su coeficiente estequiometrico es tres, resulta en el denominador x por x3 es x elevado a la cuarta y no al cuadrado.En segundo lugar a los 0,5M del producto se le deben restar (x+3x)=4x y no dos como escribiste. Gracias por tu trabajo: Juan Alberto
Hola. Estas confundido Juan Alberto. Es cierto que la ecuación que se forma es de cuarto grado porque es 3x al cubo por x dando x a la cuarta. Te agradezco por eso. Pero en el caso del NH3 es 0,5 – 2x porque ese 2 es el coeficiente estequiométrico del producto. Quiere decir que se consumen 2 moles de amoníaco.
muchas gracias el químico esta super muy bien explicado me sirvió mucho 🙂
Un placer Pamela te esperamos cuando quieras
De nada Pamela. Te esperamos cuando gustes…
muy buen explicado..
hola gracias de verdad me gustaria que ampliaras los temas por que me gusta como los desarrollas
Gracias Laura cuando gustes haceme preguntas
Hola Laura escribeme cuando gustes.
Hola, umildemente creo que Juan Alberto tiene razón cuando dice que 3x va elevado a la tercera y resulta en el denominador 27x^4.
Kc = [ NH3 ]2 / [N2] . [H2]3
Kc = [ 0,5 – 2x ]2 / x . (3x)^3
Saludos.
Es cierto Marcelo pero el denominador esta bien es 0,5m – 2x y no como decía Juan Alberto. Agradezco las correcciones desde ya saludos
Muchisimas gracias !! Por fin estoy aprendiendo Equilibrio químico después de tanto buscar en diferentes paginas 😀
Es un placer Flor. Para eso estamos. Difundi el sitio con tus conocidos besos
es una buena pagina por que se encontro mi tarea
Hola, no si a esta altura lo llegarás a leer pero lo comento por las dudas. En un párrafo (explicando el cociente de reacción escribiste lo siguiente): «Si Q es mayor que K, las concentraciones o presiones parciales de los productos son mucho mayores, entonces la reacción tiende a formar reactivos, es decir, hacia la derecha. Si Q es menor que K, la reacción ira hacia la derecha, es decir, hacia el sentido de la formación de los productos.» Si no estoy confundido, donde dice «…entonces la reacción tiende a formar reactivos, es decir, hacia la derecha…» no debería decir hacia la izquierda? Saludos y gracias.
Es posible Matías lo revisare. Abrazo.
No se si para este momento te sirva que te aclare esto pero para futuros lectores quizás esto les sea util.
Para efectos de una mejor comprensión, utilizaremos términos como reacción directa y reacción inversa.
Siendo la reacción directa aquella en la se consumen los reactivos para formar los productos
ejemplo: A + B —> C, en otras palabras, las reacciones que van hacia la derecha.
La reacción inversa tiene la siguiente forma A + B K La reacción predominante hasta alcanzar el equilibrio es la inversa
pero
Cuando Q < K Es la reacción directa la que predomina
Espero con esto las dudas de los futuros lectores queden resueltas.
Un saludo y para mayor información
consulten al Químico o pueden visitar mi web.
https://www.quimicaparaingenieros.com/
Creo que el comentario sufrió un error en la redacción. Corrijo
La reacción inversa tiene la siguiente forma
ejemplo: A + B K La reacción predominante hasta alcanzar el equilibrio es la inversa
pero
Cuando Q < K Es la reacción directa la que predomina
Espero con esto las dudas de los futuros lectores queden resueltas.
Un saludo y para mayor información
consulten al Químico o pueden visitar mi web.
https://www.quimicaparaingenieros.com/
Hola Leopoldo. La verdad no se te entiende el mensaje de reacción inversa. Creo que los lectores entienden que es directa e inversa. A + BK ???.
hola me gustaria entrevistarlo para mis tareas y conocer mas de los articulos
Como quieras alma. Avisame.
Excelente trabajo bueniiisiiimo….!!!!
Me sirvio de mucho…Graciass…Una pregunta usted x casualidad no dara cursos de asesoria..
Hola Daiana. Pronto daremos clases de apoyo online. Estas intereada?.
Yo Siiiiiii , excelente explicacion !
excelente , quisiera saber sobre el porcentaje de conversión , como hago quiero saber eso
No se a que te referis
hola, estoy cursando analista en calidad de alimentos y no puedo resolver este ejercicio
en un recipiente de 5dm3 que inicialmente contiene 15 mol de HI(g), se agregan 0.03 moles de I2(g) y 0.30 moles de H2(g) a 445°C. Kc: 64 a dicha temperatura.
Calcular concentraciones de las tres especies en equilibrio, teniendo en cuenta la reacción:
H1 + I2 2HI
Sabes que por acá me es imposible por razones de tiempo elaborar problemas tan extensos. Pero en el post hay alguno con esta reacción. Lee la teoría y lo entenderás. Lo primero que debes ver es para donde se dirige tu reacción. Aparte esta mal balanceada.
H2 + I2 <---> 2 HI
Debes dividir los moles por el volumen en litros para saber las molaridades, que son las que van en el ejercicio.
Por ejemplo: M H2 = 0,30 moles/5 = 0,06 M Es solo el comienzo lee más la teoría.
muchas gracias por tu pronta respuesta. el ejercicio esta en el libro de eudeba «temas de quimica general».
intente hacerlo de la manera q me explicas y no me da el resultado q da en el libro como respuesta.
tb lo hice tomando como dato q la cant de moles de I2 e H2 es la concentracion o sea la molaridad y no la cantidad de moles en 5 dm3 pero tampoco me da el resultado
lo plantee haciendo como lo explicas en el tema pero tampoco da.
es muy buena la teoria q expones no solo de este tema sino tb de otros mas, y me interesaria saber lo de las clases de apoyo online.
Que bueno Natalia, decime de donde sos.
el planteo de la reaccion fue un error de tipeo.
cual
Buenas Tardes el quimico que pena molestarlo usted me podria explicar como hacer este ejercicio
El método de Mohr se emplea para la determinación de cloruros en aguas. Este principio se basa en la
presencia de un exceso de plata (Ag2+), que cuando la concentración de cloruro se va extinguiendo, la
concentración del ion plata aumenta a un nivel en el cual se excede el producto de solubilidad del cromato de
plata y se comienza a formar un precipitado marrón rojizo.
????????+ + ????????− ⇋ ???????????????? ↓ (Ksp=3×10-10 M2) (6)
2????????+ + ????????????4
2− ⇌ ????????2????????????4 ↓ (Ksp=5×10-12M3) (7)
Esto se toma como evidencia de que todo el cloruro se ha precipitado. Puesto que se necesita un exceso de
Ag2+ para producir una cantidad visible de Ag2CrO4.
a. ¿Cuál será la concentración en equilibrio de los iones de plata en mg/L, con base en el producto de
solubilidad, cuando la concentración de cloruro se reduce a 0.2 mg/L?
b. Si la concentración del indicador cromato (CrO4
2-) usado es 5×10-3 moles/L, ¿Cuánto es el exceso de ion
plata en mg/L que tiene que haber antes de que comience a formarse un precipitado rojo?
Luis no resolvemos problemas tan extensos por razones de tiempo.
Hola.
Tengo una duda, en el problema del amoniaco te sale una ecuación de grado 4, ¿cómo despejas x?
Gracias.
Es buena tu pregunta la debo reveer ya que creo que hay algún error.
Estimado te hago una consulta respecto a ejercicio 4.
Para determinar el valor de la constante de equilibrio utilizas la concentración del H2 calculada en base a los 2000g iniciales. Entiendo que esto es un error ya que esa es la concentración inicial y no la de equilibrio. Por lo cual como está definido el ejercicio no es posible determinar el valor de kc en base a los datos facilitados.
Saludos y aguardo por vuestra respuesta.
Hola Mati gracias por la observación. Es verdad lo que decías en el sentido de que hay que calcular la concentración molar del H en el equilibrio. Sin embargo nos encontraremos con un valor prácticamente igual ya que deberíamos restarle al 100 M una cantidad insignificante que es la concentración que se genero de CH4 que si observas es 1,37×10 a la menos 3 M multiplicada por 2 porque por cada mol de metano se consumen 2 de hidrógeno. Entonces se le restará al 100 M el 2,74×10 a la menos 3 M dando casi el mismo resultado y no afectando el valor final. Hare la aclaración peor el resultado esta bien.
Buenas tardes: Me parece bien este sitio que publicas y permites comentarios, correcciones y opiniones, esto es construir y divulgar conocimiento, aceptando que siempre podemos mejorarlo, estoy en tercer año del profesorado de química, y trabaje 22 años en un lab farmacéutico, síntesis orgánica y control de calidad.
Saludos, Gustavo de Argentina
Gracias Gustavo, también soy Argentino. Que te vaya muy bien
Hola, encantado con tu web. Recientemente he creado una donde hablo de química y justo ahora estoy por tratar el tema de Equilibrio Químico.
Interesante contenido, yo agregaria mas ejemplos y ejercicios.
Un saludo
Saludos Leonardo y éxitos con tu proyecto.
Saldrías con mi profesora de química? Es una soltera muy guapa 🙂
Mandame la foto. jaja
me pueden explicar que relación existe entre los distintos tipos de concentración y las constantes de equilibrio.
Muy general la pregunta y nada específica.
gracias por hacerme la puta tarea
Me encanto. Yo soy estudiante de la eso y me a ayudado mucho.
Gracias Paco.