Termoquímica
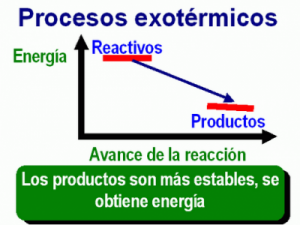
La termoquímica trata de las cantidades de calor que acompañan a las reacciones químicas bajo determinadas condiciones. En algunos casos tenemos reacciones que liberan calor al generar los productos, a estas se las llama exotérmicas. En otros las reacciones para que se produzcan necesitan de un suministro de calor para que se puedan producir. Se las llama endotérmicas. Estas cantidades de calor se pueden medir mediante un parámetro termodinámico muy conocido. La variación de entalpia. Su símbolo es ∆H. Por definición es la variación de calor de un sistema en una transformación a presión constante. La convención más aceptada es la siguiente.
Reacciones exotérmicas: Liberan calor. ∆H negativo.
Reacciones endotérmicas: Absorben calor. ∆H positivo.
Los ∆H de formación son los calores para la formación de un mol de un determinado compuesto en condiciones estándar. Temperatura de 25°C y presión normal. Existen tablas donde figuran estos valores. Por concepto el ∆H para la formación de un mol de un elemento puro es 0. Con la excepción de ciertas formas alotrópicas. Cuando vemos los valores de diferentes ∆H veremos también que se coloca o especifica le estado físico del compuesto. Porque influyen en los valores de entalpía los estados físicos de los compuestos. Por ejemplo. La formación de un mol de agua líquida a 25°C tiene un valor de -68.32 Kcal y la de un mol de agua en estado vapor de -57.80 Kcal.
Uno de los ∆H más pedidos en los ejercicios de termoquímica es el ∆H de Reacción.
Si tenemos una reacción hipotética:
aA + bB——> cC + dD
y queremos calcular el ∆H de esta reacción, es decir, el calor que acompaña a toda la reacción. Debemos hacer la sumatoria total de todos los calores de los productos y de los reactivos y finalmente restarlos. Ese resultado nos dará el calor de reacción a presión constante, o sea, el ∆Hr.
∆H r = ΣQp – ΣQr = Σ∆Hp – Σ∆Hr
Ejemplo:
CaO + H2O ——> Ca(OH)2
De tabla podemos fácilmente extraer los valores de los ∆H de formación de los compuestos participantes de la reacción:
∆Hf Ca(OH)2 = -235.8 Kcal ∆Hf CaO = -151.9 Kcal ∆Hf H2O = -68.32 Kcal.
∆H r = Σ∆Hp – Σ∆Hr
∆H r = -235.8 Kcal – [ -151.9 Kcal + (-68.32 Kcal)].
∆H r = -235.8 Kcal – (- 220.22 Kcal)
∆H r = – 15.58 Kcal.
Ley de Hess:
Hess enuncio una ley muy importante aplicada a la termoquímica. ¨La variación de Entalpía en una reacción química va ser la misma si esta se produce en una sola etapa o en varias etapas¨. Es decir, que la suma de los ∆H de cada etapa de la reacción nos dará un valor igual al ∆H de la reacción cuando se verifica en una sola etapa. Esta ley ha sido muy utilizada para la resolución de problemas que a veces causan muchas dificultades para los alumnos pero en realidad veremos que es sencilla.
Básicamente nos dan varias reacciones pero nos preguntan por una en especial. Entonces lo que tenemos que hacer es, combinarlas de tal forma que luego de cancelar varios términos solo nos quede la reacción específica que nos preguntan. Se usan movimientos matemáticos, como multiplicación, inversión y cambio de signo, etc.
Problemas:
1) El nitrato amónico se descompone según la reacción:
NH4NO3(S) ——> N2O(g) + 2 H2O(g) ∆H = -37 Kj
Calcular ∆H cuando:
a) Se descomponen 5 gramos de Nitrato de amonio.
b) Se forman 2 gramos de agua.
c) Se forman 0,600 moles de monóxido de Nitrógeno.
a) Según la reacción, al descomponerse un mol de la sal ( 80 grs.), se producen 37Kj de variación de entalpía. Por lo tanto al descomponerse 5 gramos, se producirán:
5grs. x 37Kj / 80grs. = -2.31Kj (Se mantiene el signo negativo ya que sigue siendo una reacción exotérmica).
b) Cuando se forman dos moles de agua se generan 37Kj de energía. Dos moles tienen una masa de 36 gramos. Por lo tanto, al formarse 2 gramos de agua se producirán:
2grs. x 37Kj / 36grs. = – 2.05 Kj
c) Al formarse un mol de N2O (44grs.), se genera 37Kj de energía calórica. Al formarse 0,600 moles de N2O se generaran:
0.600 mol x 37Kj / 1 mol = – 22.2 Kj
2) La entalpía de combustión de un compuesto orgánico de fórmula C6H12O2 es = –2540 KJ/mol
Sabiendo que la entalpía estándar de formación (∆Hf) del CO2 es –394 KJ/mol y el ∆Hf H2O es -242 KJ/mol.
Calcular:
La entalpía de formación del compuesto orgánico.
Solución
Para cualquier compuesto orgánico la reacción de combustión es:
C6H12O2 + 8 O2 ——> 6 CO2 + 6 H2O ΔH1 = – 2540 KJ/mol
Las entalpías de formación del CO2 y del H2O son:
C (grafito) + O2 (g) ——> CO2 (g) ΔH2 = – 394 KJ/mol
H2 (g) + ½ O 2(g) ——> H2O ΔH3 = – 242 KJ/mol
La formación del compuesto orgánico que se pretende hallar es:
6 C(graf) + 6 H2 (g) + O2 (g) ——> C6H12O2 ΔH = ?
A las ecuaciones de formación del CO2 y de H2O las multiplicamos por 6. Y a la primera. La de combustión, la invertimos, ya que el compuesto C6H12O2 debe estar a la derecha como exige la reacción que estamos averiguando.
6 C (grafito) + 6 O2 (g) ——> 6 CO2 (g) ΔH1 = – 394 KJ/mol x 6 = -2364 Kj
6 H2 (g) + 3 O2 (g) ——> 6 H2O ΔH2 = – 242 KJ/mol x 6 = -1452 Kj
6 H2O + 6 CO2 (g) ——> C6H12O2 + 8 O2 ΔH3 = + 2540 KJ/mol
Como vemos, a la derecha tenemos 8 moles de oxígeno que se cancelan con los 9 moles en total de oxígeno de la izquierda quedando un solo mol de O2 a la izquierda. Por otra parte observamos que los moles de CO2 de la izquierda se cancelan con los de CO2 de la derecha. La suma global nos da:
6 C (grafito) + 6 H2 (g) + O2 (g) ——> C6H12O2 ΔH = – 1276 KJ
3) Calcular la entalpía standard de formación del sulfuro de carbono (CS2).
C (s) + 2 S(s) → CS2 (l)
CS2 (l) + 3 O2 (g) → CO2 (g) + 2 SO2 (g) ∆H = -1072 Kj
C(s) + O2 (g) + → CO2 (g) ∆H = -393,71 Kj
S(s) + O2 (g) → SO2 (g) ∆H = -296,1 Kj
La primera reacción es nuestro objetivo. Las últimas 3 las usaremos para transformarla en la primera.
Observamos que la segunda nos conviene invertirla ya que el sulfuro de carbono debe encontrarse a la derecha y no a la izquierda. Invertimos también el signo del cambio de entalpia.
CO2 (g) + 2 SO2 (g) → CS2 (l) + 3 O2 (g) ∆H = +1072 Kj
La tercera quedara como la vemos ya que el carbón sólido está ubicado a la izquierda tal como tiene que estar en la reacción principal.
C(s) + O2 (g) + → CO2 (g) ∆H = -393,71 Kj
Por último en la cuarta reacción el azufre esta a la izquierda como debe estar. Sin embargo notamos que será necesario multiplicar por 2 a esta reacción para obtener los dos átomos de azufre necesarios que exige la reacción principal.
2 S(s) + 2 O2 (g) → 2 SO2 (g) ∆H = 2.(-296,1 Kj) = 592,2 Kj
Si hacemos la sumatoria general se eliminaran los oxígenos innecesarios. No hay oxígenos en la reacción de formación del CS2. Podemos contar 3 moléculas de oxigeno en la izquierda y 3 a la derecha. Por tal motivo quedan anulados. Lo mismo sucede con el CO2 una molécula de cada lado y con el SO2, dos moléculas de este de cada lado.
CO2 (g) + 2 SO2 (g) —> CS2 (l) + 3 O2 (g) ΔH = + 1072 Kj
C (s) + O2 (g) —-> CO2 (g) ΔH = -393.71 Kj
2 S (s) + 2 O2 (g) —-> 2 SO2 (g) ΔH = 2.(-296,1 Kj) = -592,2 Kj
Por último calculamos el ΔH total sumando los ΔH de cada reacción. ΔH total = 86.09 Kj
Por ultimo calculamos el ∆H total sumando los ∆H de cada reacción.
∆H Total = 86,09 Kj
Por ultimo calculamos el ∆H total sumando los ∆H de cada reacción.
∆H Total = 86,09 Kj
Artículos relacionados:
muuy buena información,completa y concisa,la voy a recomendar…algo de cinética química falta…
si es cierto falta
te sacastes un 10 pero alrreves ..enserio tu trabajo me alludo mucho te felisito..animo la vida sigre
MUY BUEN TRABAJO ENSERIO ME AYUDA MUCHO QUE HAYAN ESCRITO ESTO
muy buena informacion antes no le entendia pero grasias a esta inf. ya le entendi muchas grasias
Nos alegramos Gustavo
excelente lo han explicado todo de una manera muy practica, ahora lo veo todo mas sencillo.. Gracias.
les recomiendo esta pagina
De donde salen los valores de ∆H??
Cuales?
wow si sirvio bastante de ayuda muchas gracias y saludos
Muy bueno gracias a esto lo entendí parece sencillo los valores de H te lo dan en el problema
Muy clara la información, bien explicada. Gracias
Gracias Areli cuando gustes visitanos.
muy buena informacion,como no sakan asi de calorimetria
cordial saludo
Abrazo Miguelito
Muy buena información, pero bajo que condiciones se cumple?
Puntualmente que
disculpa me puedes decir cual es tu apellido. quiero saberlo porque lo necesito, ya que quiero hacer una cita de tu artículo para un proyecto de Química. espero tu respuesta pronto gracias
Patricio Andrés Arroyo. Bioquímico
no entendi lo que dijiste
En el problema I no salen los mismos valores de ∆H
Hola me podrían ayudar a sacar reacción de este compuesto DHf= C2H2 para luego calcular la entalpia la duda es que no entiendo como se forma la reacción y cómo balancear de acuerdo a la ley de hess