Básicamente existen tres tipos de isomería en química orgánica.
Isomería Estructural: Estos compuestos tienen la misma fórmula molecular, pero en la fórmula desarrollada se ven estructuras distintas.
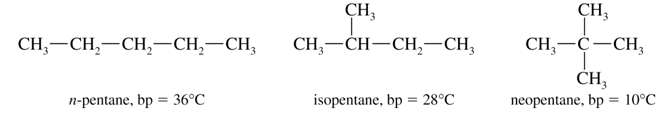
Isomería de Esqueleto: Aquí, aparecen alternativas distintas en las moléculas que pueden ser lineales o ramificadas. Por ejemplo, en los alcanos de cadena de 4 o más carbonos. En el caso del pentano, podemos tener al metil – butano, al pentano lineal o al 2,2 dimetil propano.
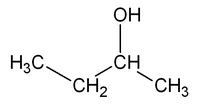
Isomería de Posición: Aparece cuando un cierto grupo funcional cambia de posición con respecto a una cadena principal. Por ejemplo es muy común en los alcoholes. Ejemplo: Butanol o 2-butanol. También se presenta en aquellas moléculas con dobles enlaces. El doble enlace puede estar al principio de la cadena o en otra posición distinta.
CH3 – CH2 – CH2 – CH2OH (Butanol-1)
(Butanol-2)
Isomería de Función: Existen moléculas que tienen la misma fórmula molecular pero y hasta el esqueleto es el mismo, pero sus grupos funcionales difieren. Por ejemplo, las cetonas con los aldehídos.
Isomería espacial geométrica:
En este tipo de isomería, el tema va más allá de un solo plano. Se presenta puntualmente cuando hay dobles enlaces. En los carbonos del doble enlace, deben existir sustituyentes distintos para cada átomo de carbono. Sin embargo hay dos sustituyentes que son iguales entre carbonos distintos. Pero, acá viene la variación. Esos dos sustituyentes diferentes pueden estar en el mismo plano del doble enlace o en planos distintos por encima y por debajo del doble enlace. Esto hay que aclararlo muy bien, porque no se aprecia en una molécula dibujada en una hoja. A diferencia de la isomería anterior, la estructural, esta se ve solo en un plano.
Cuando los dos sustituyentes iguales quedan en el mismo plano del doble enlace, se llama isómero cis, y si quedan en planos distintos, uno por abajo y otro por arriba se llama isómero trans.
Esto es de una importancia crucial, ya que este leve cambio le confiere a las moléculas propiedades diferentes. Esto se nota por ejemplo, en algunos medicamentos, en los que este cambio de isómero cambia radicalmente las propiedades al punto de que puede servir o ser totalmente inútil.
Ejemplo:
Isomería Óptica o Estereoisomería:
Cuando un carbono tiene cuatro sustituyentes diferentes, este átomo se convierte en un átomo ópticamente activo. También se lo llama a estos carbonos, carbono quiral. Que significa esto?. Es una propiedad que tienen algunas sustancias de desviar el rayo de la luz polarizada, hacia la derecha o hacia la izquierda. La luz polarizada no es natural, se obtiene gracias a un instrumento llamado polarímetro. Este convierte la luz común en luz polarizada. La luz polarizada es aquella que se mueve o avanza en un solo plano, a diferencia de la luz común que se mueve en infinitos planos. Los compuestos que presentan moléculas iguales pero que desvían a esta luz en direcciones distintas, se llaman enantiómeros. A los que desvían la luz polarizada a la derecha, se los llama isómeros dextro rotatorios (+) y a los que la desvían hacia la izquierda se los llama levo rotatorios (-).
Al igual que en los casos de los isómeros cis y trans, el cambio entre levo y dextro rotatorios es crucial para ciertas propiedades. Algunos medicamentos presentan estas diferencias solo por ser dextro o levorotatorias. Ejemplo:
Aquí observamos al ácido láctico, que tiene el carbono central rodeado por cuatro sustituyentes diferentes. Se dice que son imágenes especulares entre sí. Ya que es como si se miraran al espejo al confrontarlas. Las moléculas son prácticamente iguales en cuanto a la disposición de sus átomos , pero no son superponibles entre sí. Obsérvese el H y el OH.
Hay muchos ejemplos más. En Química Biológica tenemos a los aminoácidos, a la misma glucosa que es el mososacárido más conocido. La glucosa tiene a 4 átomos quirales de sus 6 en total. Tiene 16 moléculas isómeras en total. Cada una con su propio nombre. La cantidad de isómeros se calcula con la fórmula 2 elevado a la n. Entonces en este caso es 2 a la cuarta igual a 16.
Existen dos tipos de estereoisómeros. Los enantiómeros que son los que se diferencian en la dirección a la que desvían la luz polarizada y son imágenes especulares entre si. Por otro lado tenemos a los diastereoisómeros, que son aquellos que no son imágenes especulares entre si.




Muchisimas gracias, busque mucho tiempo esta información.
Me pone felíz ese es nuestro objetivo
Super buena información, muy clara y resumida. Me sirvió de mucho para comprender el tema. Gracias.☺
Gracias Mardely. Exitos.
deme un beso
Si sos mujer claro que si jaja. Escribime a mi email.
Muchas gracias me sirvió mucho
Que bien Rebecca. Exitos.
Cómo lo busco en youtobe muy interesante su video
Hola Sindy. Si entras al video verás el canal. Besos.
Hola para ver si me puede resolver estos ejercicios
Cuáles?
gracias a ustedes mis amores
Si esta muy buena la informacion
Entonces en la isomería de posición no cuentan alcanos verdad?
No
Hola tengo una consulta en el caso del buteno cual sería su isomero estructural? ya que cis-trans es isomeria espacial geometrica no?
Hola. Buteno 1 o Buteno 2?
Hola buenas tardes,quería saber si puede plantear y resolver ejercicios propios de Química Inorgánica, como por ejemplo, determinar el carácter ácido-base de un compuesto mediante tablas de constantes de equilibrio en solución acuosa, o también por ejemplo, algún ejercicio de Complejos, esos del nombramiento no hace falta, sino más bien aquellos que tengan que ver con la Teoría del Campo Cristalino por ejemplo. Muchas gracias.
Hola por razones de tiempo no resolvemos ejercicios tan extensos.
Hola! La verdad, la información está increíble! Muchas gracias por compartirla con nosotros. Me sirvió muchísimo!
Me alegro Any
muchas gracias me ayudara bastante para mi examen
Me alegro muchísimo.
Eres genial. Me hiciste un gran favor. Gracias.
isiste un gran trabajo
Gracias me alegro que te haya servido
Justamente lo que buscaba ✋
Me alegra Luis
si es verdad tiene toda la razón jiji
Bastante completo el material! Felicidades 🙂 … Dios le bendiga mucho.
Gracias Camila, igualmente bendiciones y éxitos en tu vida.
Hola! Consulta de g-cm3 a kg-L ??? Tengo 28 g-cm3 hice así: 28g 1kg sobre1000g saque g. 1000cm3 sobre litro saque cm3 eso sería 28 por mil me queda x. Kg sobre litro? ????????
Esta bien el proceso
Hola Patricio gracias por compartir esta información es muy interesante me ha servido de mucho; un servidor es docente de bachillerato y también imparto la asignatura de Química. Muchas gracias.
Hola José. Agradecido por tu comentario tan positivo. Te comento que también tenemos disponible un libro con muchos temas para alumnos y docentes. Cualquier cosa para más detalles consúltame. Abrazo.
yo tambien quiero ser quimico T-T pero la quimica es un poco dificil u.u
hola disculpe quisiera saber quien es el autor me podrian ayudar cn eso por favor
Yo. Patricio Andrés Arroyo: Bioquímico y Profesor.
gracias 😉
Hola me puede ayudar y recomendarme donde puedo encontrar información breve de los isomeros en la naturaleza así comocon tres ejemplos de isomeros con su tipo, e importancia en la naturaleza se lo agradeceré mucho pues se me está complicando gracias saludos
EXCELENTE
Gracias Zuli.
Muchas gracias me ayudo mucho; De casualidad no tendrás información acerca de «Elaboración De Cubrimientos Electrolíticos». Gracias y Saludos.
O algo con que me puedas brindar ayudar acerca de eso?
muy buena la pagina!!! me podrias explicar como seria un enlace sulfon? es para desarrollar la siguiente cadena
3 sulfon – 6 carboxil – 8 carboxi – 9 decil – hexadcino.
muchas gracias
Como se escribe?
Muchas Gracias m fue muy util la información.
Gracias Raquel
muy buena información
Gracias
Muy buena y clara explicación, Gracias
De nada Edith. Me alegro que te sirva.
Excelente espacio, me gusto mucho porque encontré lo que buscaba.Gracia por tu ayuda ELQUIMICO
Gracias Karen querida. También estoy en youtube. (El Santo)
muchas gracia eso era lo k buscaba i lo encontre
Gracias por visitarnos. Empezaremos a dictar cursos de Química y Física. Enterate aquí.
http://www.quimicayalgomas.com/sin-categoria/cursos-clases-quimica/
Hola me encanto justo la información que buscaba. Le hago una consulta su libro como lo puedo conseguir?? Muchas gracias.
Hola Greisy. El libro e smás de química general no de orgánica. Pero entra aquí y mirá más información. El precio actual es de 14 dolares.
https://quimicayalgomas.com/ebook-bases-de-quimica-general/
Escribime cualquier cosa a [email protected]
mi nombre es manuelis muchas gracias me cirvio de todo
Genial Manuelis
hola patricio andres arroyo. me encanta tu publicacion, no me funciono en nada pero gracias igualmente saludos y un beso de parte de rosita ;*
Hola Rosita querida. Que necesitas que no te sirvió?.
Disculpa sabe cuáles son los isómeros que han marcado grandes cambios en la vida cotidiana
Hola, no.
Muchas gracias
Tengo el tema un pocos más claro
Genial Carlos.
Hola, tengo una duda. Pueden dos compuestos tener dos tipos de isomerí a la misma vez
muy útil información en pocos sitios web se puede encontrar información buena , útil y confiable mis mayores felicidades y suerte con el grandioso trabajo que os estáis haciendo
Gracias Seba. Abrazo y éxitos.
Entonces el último ejemplo cómo se llama?
El último que.
muchas gracias me ayudo de mucho
De nada. Besos.
Muchas gracias usted es lindo
Gracias Ari. Escribime a mi correo cuando gustes.