Las Aminas son compuestos que se obtienen cuando los hidrógenos del amoníaco son reemplazados o sustituidos por radicales alcohólicos o aromáticos.
Si son reemplazados por radicales alcohólicos tenemos a las aminas alifáticas. Si son sustituidos por radicales aromáticos tenemos a las aminas aromáticas.
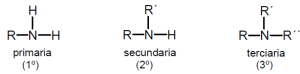
Dentro de las aminas alifáticas tenemos a las primarias (cuando se sustituye un solo átomo de hidrógeno), las secundarias (cuando son dos los hidrógenos sustituidos) y las terciarias (aquellas en las que los tres hidrógenos son reemplazados).
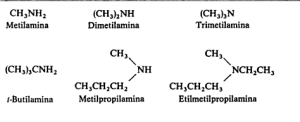
En el ejemplo vemos que también podemos clasificar a las aminas alifáticas no solo si son primarias, secundarias o terciarias sino que pueden ser simples o mixtas.
Simples son las que presentan los mismos radicales alcohólicos y mixtas las que tienen distintos radicales alcohólicos en la amina. La metil etil amina y la metil dietil amina mostradas en el ejemplo son mixtas.
En la metil amina observamos que el (-NH2) es un radical, se denomina amino. En las aminas secundarias se forma el radical imino (=NH), en este caso el nitrógeno tiene dos valencias libres en lugar de una.
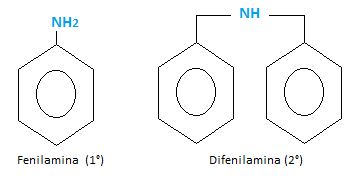
Las aminas aromáticas también presentan aminas primarias, secundarias y terciarias.
Ej: Fenil amina y Di fenil amina
Nomenclatura: Como observamos los nombres de las aminas se colocan anteponiendo el nombre del radical derivado del alcohol seguido por el término amina. Si dos o tres radicales son iguales se antepone el prefijo de cantidad (di o tri) al nombre del radical. Si hay radicales de distinto peso molecular, se nombra primero el de menos carbonos y liego le mayor.
Métodos de obtención:
Combinando al amoníaco con yoduros alcohólicos. En el Ej obtenemos etilamina.

Si la reacción transcurre, el producto formado se puede volver a hacer reaccionar con el derivado iodado dando otras aminas, secundarias y terciarias.
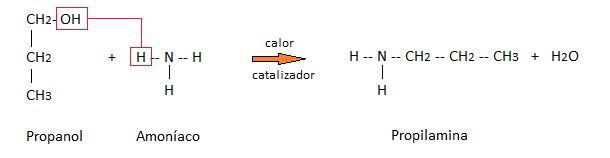
Haciendo reaccionar al amoníaco con alcoholes en presencia de calor y catalizadores especiales.
Propiedades físicas:
La primera es gaseosa, hasta la de 11 carbonos son líquidas, luego sólidas.
Como siempre, el punto de ebullición aumenta con la cantidad de carbonos.
Con respecto a su solubilidad, las primeras son muy solubles en agua, luego va disminuyendo con la cantidad de átomos de carbono.
Propiedades químicas:
Combustión: Las aminas a diferencia del amoníaco arden en presencia de oxígeno por tener átomos de carbono.
Poseen un leve carácter ácido en solución acuosa.
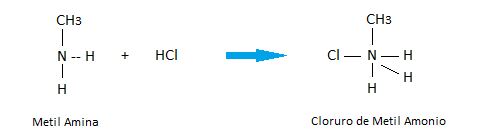
Formación de sales:
Las aminas al ser de carácter básico, son consideradas bases orgánicas. Por lo tanto pueden reaccionar con ácidos para formar sales.
Reacción de diferenciación de las aminas:
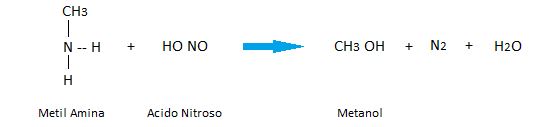
Las aminas 1°, 2° y 3° pueden reaccionar con al ácido nitroso. Esta reacción se aprovecha para poder distinguirlas.
Aminas primarias:
Aminas secundarias:
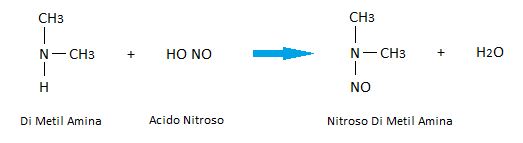
Aminas terciarias:
En este caso, las aminas terciarias no reaccionan ante el reactivo ácido nitroso.
Como vimos, estas tres reacciones distintas permiten diferenciar a las aminas 1°, 2° y 3°.
De las aminas aromáticas merece ser mencionada la fenilamina, conocida también como anilina.
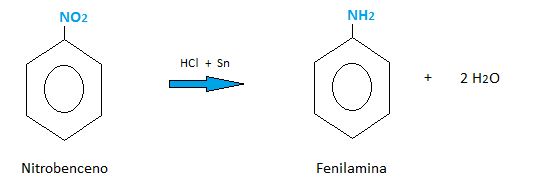
Se la puede obtener a partir de la siguiente reacción (en medio ácido).
Propiedades físicas:
Es líquido, incoloro y de aspecto aceitoso. Olor desagradable. Su punto de ebullición es de 184°C.
Es soluble en solventes orgánicos.
Propiedades químicas:
Presenta las mismas características químicas que las aminas alifáticas. Arde en presencia de la llama (combustible). Tiene un carácter básico más débil que las otras aminas.
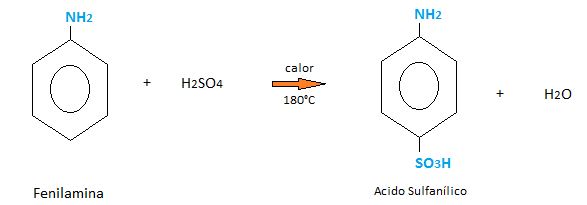
Reacciona con el ácido sulfúrico a temperaturas elevadas.
Otro reactivo que es afín con la anilina es el ácido acético. En caliente también.
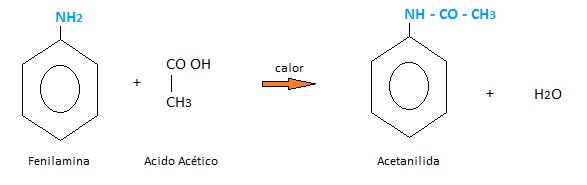
Usos:
Es muy usada en la industria de los colorantes, como el caso del azul y negro de anilina. También ha tenido utilidad en la preparación de fármacos y en la industria fotográfica.
A continuación les dejo el tutorial bien explicado del tema «AMINAS». No se lo pierdan.
Otros temas de interés:
Muchas gracias por la explicación, el desarrollo del tema que hiciste fue muy sencillo de comprender y me sirvió de mucho. Gracias 🙂
oye muy bien
Gracias
Me alegro Leandra.
perdon, pero ¿una amina alifatica no es en la que se sustituye el hidrogeno por un un grupo alquilo?
Correcto
Excelente información muchas gracias 💞✨
Gracias Lizeth
MUY INTERESANTE LA EXPLICACION DE AMINAS
muy buen aporte gracias 🙂
MUY BUEN TRABAJO DE LAS AMINAS LOS FELICITO 😉
Muchas gracias.
Muy buena explicación. gracias
Nos alegramos Yaque.
Las aminas pertenecen al grupo de las grasas??
No.
muchas gracias me ayudo bastante…
Nos alegramos Arley
soy profesora de Química en Cuba y me especializo un poco en la gestión de contenidos para software fundamentalmente para nivel medio superior, buscando informaciones de diversos temas , te encontré y bueno te saludo. La Química a través de la virtualidad es complicada sobre todo en la parte experimental por los efectos «mágicos» pero igual se logran cosas.
Gracias por tus saludos. Interpreto que te gusto la página.
muchas gracias por el aporte, sin embargo tengo una duda, me podrías decir ¿cual es la relación que tiene la anilina con los alimentos??
Hola. No se espero que ninguna. Es muy tóxica
de verdad muy buena imformacion los felicito……… 🙂
Gracias Alicia
buenas tardes, amigo me gustaría saber s para una exposición usos y aplicación e importancia en aminas a nivel nutricional.
No tengo tanta información sobre aminas en nutrición. Pero dejemos esto abierto para ver si alguien puede aportar algo interesante.
Me interesan mucho recibir tu boletín mensual gracias.
Alex un placer tenerte como lector
Profesor nesesito de su ayuda
Nesesito amina de 5 carbonos
Di etil metil amina
Exactamente la amina pertece al grupo de las grasas??
No.
Profesor nesesito de su ayuda
Nesesito amina de 5 carbonos
Di etil – metil amina
eres el mejor!!
Muchas gracias me sirvió de mucho resolvio todos mi vida
Tanto? jaja me alegro
muy buena información me ha servido mucho en clases de química felicidadess!!!! 🙂
Gracias exitos
Hola, a ver si me puedes ayudar, los puntos de ebullición de las aminas son menores que klos de los alcoholes pues los puentes de hidorgeno son mas debiles, siguiendo el mismo rrazonamiento no deberian ser los PE de las amidas menores que los de los ácidos, asi como lo de los nitrilos tambien menores que los acidos pues no hay puentes de hidrogeno??
Sin embargo lo PE de amidas y nitrilos son mayores que los de los ácidos, lo de los nitrilos lo puedo entender pues la polaridad del enlace es CN es alta y puede formar fuerzas intermoleculares dipolo dipolo, pero no serán mayores que lo puentes de hidrogeno no? Por otro lado los esteres al no formar puentes de hidrogeno se dice que tienen PE simlares a los alcanos de similar peso, ahora bien los esteres tienen enlace porlar por ello los puntos de ebullición no deberian ser mayores que los de los alcanos?? Bueno son muchas cosas, espero que me puedas ayudar, no encuentro una explicación al respecto. Muchas gracias
No lo sé. Dejemos publicado por si alguien tiene la respuesta.
que puedo hacer para neutralizar agua con 5% de amina de un scrubber, y poder ingresarla a mi planta tratadora de aguas que funciona con lodos activados?
Gracias ,estoy satisfecha.
Gracias Christie
Buenos días, muy buen aporte mi estimado Patricio, una consulta, una amina secundaria es igual una amina libre??
Hola gracias. No entiendo bien la pregunta. A que le llamas libre?.
Hola buenos dias, muchas gracias por su respuesta, tenemos un registro sanitario retenido y nos están pidiendo una carta donde especifique el % de amina secundaria presente en el producto terminado, pero en el certificado de análisis de la cocoamida que compramos lo que viene es el % de amina libre, entonces no sé si ese % se refiere a amina secundaria.
Muchas gracias.
Excelente explicacion eh, ahora me va a ir muy bien en el examen. Muchas gracias!!
Saludos. ????
Excelente explicacion eh, ahora me va a ir muy bien en el examen. Muchas gracias!!
Saludos. ????
De nada Ingris, que te vaya super bien
De nada Ingris, éxitos
Profesor, La Nomenclatura De Las Aminas Secundarias Seria Igual A Las Aminas Primarias & Terciarias??
Me Puedes Colaborar Con Esta Duda…
Gracias 🙂
Si el sistema no varía. Fijate en los ejemplos que puse
Hola quisiera que me indiques sobre el tema aminas de química tengo exposición y no se mucho sobre la nomenclatura por favor
Es lo que hay en el post, no más.
quisiera saber acerca de la aminas múltiples y colinas?
cuales son las aminas de la cuarta generacion. son las aminas biodegradbles
Desconozco. Pero te publico la pregunta. Esperemos que alguien la conteste.
Intereante el contenido. Cuales son las aminas de la cuarta generacion?. Gracias divulgare la pagina
Hola Olga. Gracias. Sinceramente no lo sé.
Oye, sabes cuales funciones orgánicas son más importantes para la vida y cuales contaminan mas nuestro planeta?
Hola fernando. Noooo. Habría que tomarse mucho tiempo. Hay demasiadas y es una pregunta muy general. Y con todo respeto no le veo sentido.
hola, estoy realizando un trabajo de la entalpia de combustión de la anilina y no encuentro los productos exactos de la reacción no se si tal vez me puedas ayudar con esto, mencionas que si tienen combustión con oxigeno pero me falto un poco mas, te lo agradecería mucho
Hola Fernando. No es algo específico y no tengo tiempo de investigar. Pero lo dejaré publicado por si alguien te puede ayudar.
Hola, una duda, que pasa si la amina presenta grupos aromaticos y alifaticas?, como se llamarian?
Hay muchas. No hay en el post?.