Explicación de los conceptos de solvente y soluto.
Las Soluciones son sistemas homogéneos (iguales propiedades físicas y químicas en toda su masa), que están constituidas básicamente por dos componentes llamados Solvente y Soluto. El Solvente básicamente es el componente mayoritario de la solución, el que contiene al soluto. Por ejemplo, si pensamos en agua salada, el agua es el solvente y la sal representa el soluto. También algunos lo mencionan como Soluto y
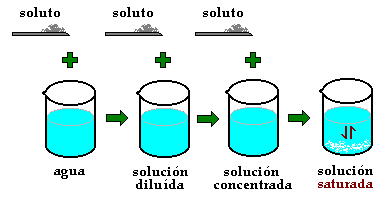
Disolvente, y a la Solución le dicen Disolución. Por otra parte, en muchos casos podemos encontrar que un solvente contiene dos o más solutos, por ejemplo agua con sal y azúcar. Este concepto también es extensible a gases y sólidos. 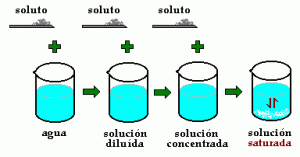 Concentración: Llamamos concentración a la relación que existe entre la cantidad de soluto y la cantidad de solución o de solvente. Es un concepto muy importante ya que en base a esto se preparan solo por dar un ejemplo, soluciones en la Industria Alimentaria o Farmacéutica. Es el caso de la llamada solución Fisiológica o suero fisiológico que se les administra a las personas por diferentes causas. Esta tiene una cantidad exacta de sal por litro de agua. A la concentración se la puede representar de distintas maneras.
Concentración: Llamamos concentración a la relación que existe entre la cantidad de soluto y la cantidad de solución o de solvente. Es un concepto muy importante ya que en base a esto se preparan solo por dar un ejemplo, soluciones en la Industria Alimentaria o Farmacéutica. Es el caso de la llamada solución Fisiológica o suero fisiológico que se les administra a las personas por diferentes causas. Esta tiene una cantidad exacta de sal por litro de agua. A la concentración se la puede representar de distintas maneras.
- Porcentaje masa en masa (% m/m): Por ejemplo 2% m/m significa 2 gramos de soluto en 100 gramos en solución.
- Porcentaje volumen en volumen (% v/v): 3% v/v es 3 centímetros cúbicos de soluto en 100 de solución.
- Porcentaje masa en volumen (%m/v): 4%m/v es 4 gramos de soluto cada 100 ml de solución.
- Molaridad: Número de moles de soluto en 1 litro de solución. El mol representa una determinada cantidad de materia de cualquier sustancia. Ejemplo. Si decimos que una solución es 2 molar (2M) tiene dos moles en 1 litro de solución.
- Normalidad: Es la cantidad de equivalentes químicos que hay por litro de solución. Si una solución es 0,5 N (0,5 normal) significa que contiene 0,5 equivalentes en un litro de solución.
Esperamos que te haya servido este artículo.
Bioquímico: Patricio Arroyo.
Otros Temas de Interés que te pueden resultar muy útiles.:
Gracias se los agradezco, son muy inteligentes, me salvan la vida! Besos los amo a todos. visitenme
Asi es es muy importante saber de soluto y solvente
Quiero saber la respuesta del cálculo..el sv de una sc de 300cm3 si contiene 60cm3 de vinagre que se utiliza para desinfectar verduras..repuesta por favor
Hola, adiós
Hola si tengo una solución constituida por 50gr de sal disuelta en 1 litro de agua es para responder
Hola quiero saber q representa el esquema.
si pongo 50 porciento de aagua y 50 por ciento de vinagre, cual es es soluto y cual es el solvente?
En ese caso podes tomar al solvente como el primero. En todo caso no tendría mucha importancia mientras puedes realizar los cálculos
hola es que estoy estudiando ingeniería ambiental y me plantean este ejercicio y la verdad no se como darle respuesta Preparar 300 cm3 de una disolución 0.3 M de ácido clorhídrico (HCl) a partir de ácido clorhídrico comercial (36% p/p y densidad 1,18 g/mL).
alguien me puede colaborar
Debes calculasr la molaridad de la segunda solución. Esa sería M2. Después con la fórmula M1 x V1 = M2 x V2 despejas el V1 y lo llevas con agua hasta 300 cm3 que es el volumen pedido. Fijate que he publicado ejercicios parecidos.
no entiendo
q cosa
calcula su masa densidad y revierte su equivalente
g = PM.L.M
g = (36.45g/ mol)(0.300L)(0.3Mol/L)
g = 3.2805 g de acido HCL puro 100 % ,pero es a a 36%.
entonces: una regla de tres 36g ———–100g
3.2805 ——–x
x = 9.1125 g de HCl al 36% pero el acido clorhidrico es liquido y conociendo la densidad el volumen será:
v= 9.1125g / 1.18g/mL = 7.72 mL de acido en un volumen completando con agua hasta los 300 ml de solucion….
¿Es posible agregar cualquier cantidad de soluto a una determinada cantidad de solvente?
Cuantos gramos de sólito y solvente se nesesitan para preparar 300g de una solución al 1.5% en p/p?
Hola profesor le pido que me colabore con este ejercicio. Calcular el peso de la sal comun (NaCl) que debe prepararse para preparar 250 g de una solucion al 3% en peso. Le agradeceria si me ayuda con este ejercicio.
Hola..como cálculo 2% p/
como saco la densidas del soluto y solvente?
Te faltan los datos no entiendo el problema. Pone e enunciado y quizá te pueda ayudar.
hola como se llama la solución donde el soluto y el solvente es relativamente exacto?
Creo que queres decir que no entra más soluto. Sería la saturada.
pues los dos por que uno disuelve al otro
el soluto es el agua y el solvente el vinagre osea se entinde.h.d.p ose higado de pescado,pero es no significa tu me entiendes jaja no mentira ojala q te ala ayudado.bye
No se te entiende nada y aclara lo de h.d.p. o borro tu comentario jaja
hola
Hola caro
Estoy haciendo un trabajo y me pide él desarrollo pero no se como colocar él concepto me pueden ayudar se que es materia y presentan información vnzada pero estoy en bachillerato gracias
No te entiendo
el mercurio
ESTA BUENA LA INFORMACION PERO UNA PREGUNTA!
DONDE ESTA: SOLUTO Y SOLUCION????
Hola. Como donde esta?. Soluto es la cantidad de soluto que se le pone al solvente. Por ejemplo. Sal en agua. La sal es el soluto y el agua es el solvente.
Acá no se dicen burradas María. Sería bueno que en vez de insultar a los que hacemos un buen trabajo de servicio en Internet, expongas tus dudas, porque veo que tenes muchas y no sabes nada.
ALTA BURRA LA INGNORANTE ESA, NO DEBE HABER TERMINADO NI LA PRIMARIA
se le puede poner el gramaje q uno desee ?
No, si bien hay una buena variación.
El agua teniendo en cuenta que el agua es es solvente universal mayoritario
El agua es el solvente universal Jime. Cual es tu pregunta?.
que es el soluto y el solventen en una solucion y 2 ejemplo que identifique el soluto y el solvente
Ahí lo explico leelo
siempre el agua es el solvente. el agua es solvente universal por mas que haya menos proporcion
No en todos los casos el agua en menor cantidad es el solvente
el agua es solvente y el vinagre soluto
Asi es
en este caso se considera el agua como solvente, siempre que aparezca el agua va sersolvente independiente de la cantidad
El agua es el solvente universal.
Ninguno es soluto, ambos son liquidos.
el agua por que es el solvente universal… el mas usado…… jaja llegue tarde a responderte
el soluto es el vinagre y el solvente es el agua
si
Eso no es una solución si no una mezcla y no es homogénea como se requiere así que ninguno por que ni siquiera se pueden combinar
siempre es el agua
Hola Profe…estoy estudiando y necesito resolver este problema y no logro resolverlo,si me ayudas te lo agradecería:
Cuanto soluto posee disuelto 190 g. de solución al 30% y densidad 1.03 g/cm3
En este caso no necesitarías la densidad si calculas masa. 190 x 30/100 =
El agua siempre es el solvente
soluto es el vinagre y solvente el agua
soluto es el vinagre y solvente es el agua
Si.
El agua es el solvente, siempre, es el solvente universal. El vinagre es una solución, no un soluto, compuesta por ácido acético (soluto) y agua, solo estarías haciendo menos concentrada la solución al agregarle más agua.
esta concepto esta muy bien muy inteiget……..11!!111
Excelente la publicacion, esta entendido al 100 % !! Gracias. =D
En la hidroponia cual seria el solvente y el soluto ?
No soy experto en esa técnica. Pero creo que se le pone sales. Así que será agua solvente y lo que le pongas solutos.
Hola me pueden dar tres ejemplos de solventes y soluto?
El solvente universal es el agua. Después se podría usar algún alcohol u otro producto orgánico. De solutos podes tener una sal como el cloruro de sodio, nitrato de potasio, etc o algun hidróxido. Hay muchos mas.
y de la solucion fisiologica.
La solución fisiológica es una cantidad de sal en agua.
Hola!! Necesito ayuda 🙁 ,, necesito que me de un concepto de la ‘importancia de soluto’ plis….
Es una pregunta muy extraña. Como importancia. Más que nada lo que tenés que saber es la definición.
Clasificacion de las disoluciones segun: su estado fisico, tipo de solvente y concentracion del soluto? Porfavor Responde (:
Según su estado físico pueden ser sólidas líquidas o gaseosas. Con respecto al tipo de solvente no se a q te refieres. Hay solventes de todo tipo pero el más usado es el agua por lejos. según concentración de soluto lo puedes expresar en % masa en masa (%m/m) o % masa en volumen (m/v) o % volumen en volumen (% v/v) como lo explico en el post
Hola ! Me sirvió de mucho, pero Me podrías dar ejemplos de soluciones? Responde, porfavor (: Gracias !
No hay ejemplos?. Sal en agua, como cloruro de sodio o sulfato de potasio en agua que e sel solvente universal. Te sirve?
ESTO ME SIRVE NECESITO EJEMPLOS DE LA VIDA COTIDIANA!!!!! PLISSSS DE SOLUTO Y DISOLVENTE DE
GAS-LIQUIDO GAS-SOLIDO GAS-GAS
SOLIDO-LIQUIDO SOLIDO-SOLIDO SOLIDO-GAS
LIQUIDO – LIQUIDO LIQUIDO-SOLIDO LIQUIDO-GAS
hola buenos dias porfa
q diferencia hay entre un soluto y un solvente
Ahí lo explicamos bien. Soluto es el componente que se agrega al solvente. El soluto esta en menor cantidad. Por ejemplo si le agregas sal al agua, la sal es el soluto y el agua es el solvente.
disculpa me podrias decir ¿cuál es la clasificación de las disoluciones por el tipo de solvente? porfavor
No hay clasificación por el tipo de solvente
Por «tipo» la única clasificación de cabria definir seria: solido-solido, solido-liquido, gas-liquido…. etc.
interesante toito
hola para preguntarte esto..
dice indica cual es el soluto y cual el solvente en cada una de las soluciones preparadas en:
1 en una vaso de precipitados mezcla 1g de kcl y 15 g de agua..
2 mezcla 2 g de azucar en 20 ml de agua..
3 mezcla 1 g de ca(OH)2 en 25ml de agua
¿ como expresarias la concentracion de estas soluciones? tengoo que desarrollar todo eso, sera que me podiras ayudar, gracias
Hola:
El solvente siempre es el agua en estos casos. Es el solvente universal o sea el mas usado por lejos en la química. Por lo tanto los otros componentes de los 3 ejemplos son los solutos respectivos.
En el caso 1 por como estan la sunidades quedaría bien expresarla en % m/m (porcentaje masa en masa)
En el caso 2 % m/v (porcentaje masa en volúmen)
En el caso 3 % m/v
Hola
como dice lo anterior el solvente universal el mas usado en la química, por lo tanto, el so-luto es la cantidad mayoritaria de la solución
No. El soluto es la cantidad minoritaria
muy bn redactado..,Esta muy buena la respuesta!!!
hola por favor me das ejemplos
El más comun sal en agua. Sal soluto y agua solvente. Creo que deje varios
muy util gracias
Para eso estamos Agus te esperamos cuando gustei le das un me gusta al sitio recibirás las últimas novedades. Besos.
HOLA ! ME PUEDEN AYUDAR !? ES URGENTE!
ESTA ES MI TAREA DIGANME SI LO QUE HICE ESTA BIEN:
1). ¿CUANTOS GRAMOS DE SOLUTO HAY EN UNA SOLUCION AL 10% DE NaCl en H2O P/P?
MI RESPUESTA: HAY 10 GS DE NaCl en 100 GRAMOS DE SOLUCION
2) CUANTOS GRAMOS DE AGUA HAY EN LA MISMA SOLUCION?
RTA: 90 GS DE H2O EN 100 GS DE SOLUCION
3) ¿QUE MOLARIDAD TIENE DICHA SOLUCION SI EL PESO MOLECULAR DE NaCl ES 58,5?
RTA:LA MOLARIDAD DE LA SOLUCION ES DE 58,5 MOLES EN 1 LITRO DE SOLUCION
4) ¿QUE NORMALIDAD TIENE DICHA SOLUCION?
RTA:ESTA NO LA SE ¡AYUDENME!
5) ¿CUANTOS ML DE SOLUTO HAY EN UNA SOLUCION AL 15% DE V/V DE KOH V/V?
RTA:HAY 15 ML DE SOLUTO EN 100 DE SOLUCION
6) ¿CUANTOS GRAMOS DE H2O Y de NaCl DEBO COLOCAR EN UN RECIPIENTE, UNA SOLUCION 5% P/P?
RTA:5GRAMOS DE NaCl EN 100 GS DE SOLUCION
95 GS DE H2O EN 100 GS DE SOLUCION
– LISTO ESAS SON POR FAVOR ES PARA MAÑANA O LO ANTES POSIBLE! GRACIAS!
Estan bastante bien salvo la de molaridad. La molaridad se calcula dividiendo los moles de soluto por el volumen en litros. Y vos no tenes el volúmen aunque podemos hacer una aproximacion. Si son 90 grs de agua suponiendo q los 10 grs de soluto no ocuan volúmen serian unos 0,09 litros. Los moles se sacan dividiendo la masa por el PM. 10 grs/58.5 dando 0,17 moles. Despues se divide 0,17 moles/0,09 lts 1.9 M.
La N es parecida pero te lo hare breve porque es mas largo. La normalidad (N) se saca dividiendo los equivalentes por la cantidad de litros. Pero los equivalentes en el caso de la sal se calculan dividiendo la masa por el peso equivalente. En el caso de las sales el Peq se saca dividiendo la masa por la cantidad de cargas + o -. En el caso de NaCl es 58,5/1 = 58.5 entonces sera 10/58.5 y da 0.17. La N entonces da 0,17 equivalentes /0,09 litros = 1.89 N (normal).
Mira el post de soluciones químicas ahi tengo muuuchos problemas de estos.
Bueno mi pregunta es la siguiennte , Sirve para la vida de un quimico a futuro el solvente y soluto?
Por supuesto
Tarea urgente me pueden ayudar
Tienes un amigo que se ha enfermado de la garganta y va al doctor para que lo revise. Le ha recetado una suspensión formulada a base de amoxicilina pues trae una infección.
A los dos días de haber comenzado el tratamiento, él sigue exactamente igual, argumentando que el medicamento no le hace efecto y que no sirve. Comenta que todavía tiene suspensión, aunque el doctor le había dicho que iba a necesitar al menos dos frascos.
El amigo le pregunta que cómo preparó la suspensión y le dice que ¡llenó todo el frasco de agua! Él le responde que está mal lo que hizo, que debió haber agregado agua hasta la marca.
La suspensión debía haberse preparado así: La concentración correcta era por cada 150 mg de amoxicilina se tenía que agregar 50 gr de agua (50 ml) y el paciente utilizó 75 gr (75 ml) de agua.
Responde a las siguientes preguntas:
¿Cuál debería ser la concentración correcta de la suspensión, expresada en porcentaje en masa?
¿Cuál es la concentración real expresada en porcentaje en masa de la suspensión que fue preparada y tomada por el paciente?
En términos de soluciones empíricas, ¿cómo es la concentración de la suspensión preparada en comparación con la suspensión que debía ser preparada correctamente?
¿Consideras conveniente utilizar un papel filtro para recuperar la amoxicilina (soluto) y volver a preparar una nueva suspensión ANTES de que el paciente tome la primera dosis?, ¿por qué?
Si de la suspensión original el paciente debía tomar 8 ml ¿cuántos ml de suspensión debe tomar de la suspensión que preparó conforme a esa concentración? Para resolver, aplica una regla de tres directa.
% m/m = masa soluto x 100 / masa solución = % m/m = 0,150 grs x 100 / 50,15 grs = 0.30 % m/m
% m/m = 0,15 grs x 100 / 75.15 grs = 0,20 % m/m
Con respecto a la amoxicilina debes consultar a un farmacéutico por las propiedades específicas de ese soluto
HOLA UNA MANDARON UNA PREGUNTA DICIENDO ¿ QUE CANTIDAD DE SOLUTO EN GRAMOS EXISTE EN LAS SIGUIENTES SOLUCIONES A)100 Ml Al 11% b)300 Ml AL 8%
C) 125 Ml AL 37%
Hola la primera debe ser 11% m/v o sea, en 100 ml de volúmen. Por lo tanto como se trata 100 coincidiendo con el porcentaje, concluímos que hay 11 grs de soluto. En la segunda, 300 ml al 8% m/v. En 100 hay 8 grs por lo tanto en 300 habrán 24 grs. En la tercera de 125 ml al 37%, hay 37 grs de soluto en 100 ml de solución, entonces 125 ml habrá:
125 ml x 37 grs / 100ml = 46.25 grs
me puede decir cual es el solvente y soluto de nafta?
El solvente es el agua y el soluto o mejor dicho los solutos son los hidrocarburos que estan disueltos en el agua
me gusta la quimica
Cordial saludo, requiero informacion del diluyente ANSOL 300, requiero informacion de mezcla:
Cuantos gls*Bbl de crudo
Tengo un crudo de 9°API, y requiero tener 21°API, mil gracias
Hola. No es el sitio para obtener esa información.
Hola, varias preguntas.
Entiendo el concepto de % m/V o % m/m pero, hay una relación proporcional entre la densidad y el % m/V? es posible decir que si tenemos 1,15 g/mL de densidad, entonces por cada 100 cm3 hay 115 gramos? afectan los gramos al volumen total? me cuesta entender la relación.
Y luego tengo este problema :
Se desea preparar 500 mL de disolución de ácido clorhídrico (HCl) 0.10 M a partir de un ácido comercial cuya densidad es 1.19 g/mL y su concentración 37.0 % m/m. Calcula el volumen del ácido que necesite para preparar esta disolución.
No entiendo qué quiere decir preparar una disolución a partir de otra cosa, es decir, cuál es el soluto, cuál el solvente, ¿cómo resuelvo este problema?
Los gramos afectan al volumen total claro. Pero si tenes la densidad no tendras problemas. Con respecto al problema tengo ejercicios similares. Debes leer el post de soluciones químicas. Con el % y la densidad calculas la molaridad de la solucion problema (M2) y con eso sacaras el volumen necesario que tendras que sacar de esta. Con la formula:
M1 x V1 = M2 x V2 sacas todo. Donde M1 V1 sería la de 500 ml. Es largo hacerlo aca entra a post de soluciones químicas ahora.
Necesito ayuda para hacer un ejercicio porfavor
como hago para sacar el valor del soluto, solvente y solucion teniendo el valor de % m/m ?
Ahi explico numerosos ejemplos. Lee el artículo
hola muy buenas las explicaciones me pudieras decir como saco el porcentaje del soluto o solvente? gracias
Hola Betty hay varios ejemplos de eso
cuál es la diferencia entre un solvente y un disolvente. Lo digo por el tinner algunos lo ponen como disolvente y otros como solvente 1. Tiene que ver algo, el que algunos tinner tengan tolueno por ejemplo y otros Metanol
Gracias!!
Solvente es exactamente lo mismo que disolvente.
disculpa me podrias dar EJEMPLOS DE DISOLUCIONES COMUNES EN EL ENTORNO
Hola. Cuando preapras una bebida como un jugo estas preparando una solución. Una taza de te o cafe. a solucion fisiologica q compras en una farmacia tambien es una solucion. Pensa en sus componentes. Si sigue steniendo dudas decime.
disculpa, cuales son las densidades de los solutos mas importantes?
Hola la verdad no se exactamente los valores pero la mayoría son solidos como las sales. Lo puedes averiguar en una tabla de densidades
Hola.me podrían ayudar en ejemplos de soluciones de distintos solventes y distintos solutos (líquido-solido, líquido-liquido,etc)
hola me puedes decir 10 ejemplos de soluciones quimicas con los distintos estados de la materia gracias…
10? jaja a ver sal en agua, alcohol en agua, una taza de té, leche descremada, sal en alcohol, éter en agua, ácido clorhídrico en agua, ácido nítrico en agua, oxígeno en agua, aleacion como bronce que tiene cobre y estaño en menor proporcion. Podes encontrar otras mas solo pensalo
hola, mi pregunta es cuales son los solutos en el suero fisologico?
Cloruro de sodio, la sal.
Hola con que tipo de formula puedo responder esta pregunta
cuantos gr en NaCl , debes agregar a 300ml de solución para obtener 0,01? RESPONDE PORFI 🙂
0,01 que???? sino especificas no se puede hacer.
cloratooo
hola, mi pregunta es…como se separan las absolutas de las soluciones
?
a q ue te referis con absolutas?
alluda soy gorgenitales tengo q explicar los componentes de una solución: saluto y solvente
Entonces este artículo sera de mucha ayuda Jorge
Gracias. me sirvió de mucho
esta muy mal explicado, la verdad que no entendi nada. Buena suerte para la proxima
Esta perfectamente explicado. Fijate los demas comentarios. Tenes algun problema de entendimiento quiza
cuando se evaporan 300 gramos de sulfato de cobre , se obtiene un residuo de 25 gramos de sulfato entonces :
1. cuantos gramos de agua se evaporaron
2. cual es el porcentaje de soluto por peso en la solución
3. cual es el porcentaje de solvente
el sulfato de cobre no se evapora. Habras querido decir la parte de agua
porque se dice que el agua es solvente universal?
Por varios motivos pero los princiales creo que tienen que ver con su abundancia y su capacidad para disolver a muchos solutos, como todos los iónicos.
Hola!Necesito soluciones con solventes gaseoso:Soluto solido,Soluto liquido y Soluto gaseoso.Me puedes dar un ejemplo para cada uno de estos?
Gracias!!
Hola. Solvente gaseoso con soluto gaseoso si, pueden ser dos cualesquiera gases como oxígeno en nitrógeno, o cloro en oxígeno, etc. Ahora soluto solido en solvente gaseoso es complicado. Lo que mas se semejaría sería polvo en suspensión pero no llega a ser solución. Y la niebla sería un ejemplo de líquido en gas que es el agua líquida en el aire
Hola , mi pregunta es : Cuales son los tipos de soluciones dar ejemplo
Acaso no esta publicada?.
gracias me sirvio mucho
cual es la concentracion de una solucion que se forma con 94gde solvente y y 6 de soluto.
6 en 100 (94 + 6) es?. 6% masa en masa (m/m). Facilísimo. Por favor lee el post q lo explico bieeen.
como puedo poner referencias de su sitio?? necesito saber como se llama para poner referencias porfavor.
Hola. El sitio es http://www.quimicayalgomas.com Mi nombre es Patricio Andrés Arroyo. Bioquímico
cual es tu nombre?
Patricio Arroyo Fer
cual es la diferencia entre soluto y solvente?
Lee el artículo y verás la diferencia. Soluto es el componente de la solución que esta en menor cantidad.
hola buenas noches por favor me ayudan con esta pregunta
cual es el soluto y solvente del acetaminofen por fa es urgente
Hola decime la composición y te ayudo
Cordial saludo Patricio
primer lo admiro en su comportamiento por ayudar a los demás y su información es muy buena.
Segundo tengo un trabajo de química y estoy un poco confundido quisiera que me ayude tengo estas preguntas.
a. Describir un producto farmacéutico utilizado en el hogar clasificado como Suspensión con sus Características generales y Propiedades.
b. Describir un producto farmacéutico utilizado en el hogar clasificado como coloide con sus Características generales y Propiedades.
si me puede colaborar se lo agradecería mucho.
Gracias Ricardo pero no soy Farmacéutico. Soy Bioquímico.
hola
me puedes ayudar
es para saber ejemplos de soluciones electroliticas y no electroliticas
Puntualmente que necesitas Karen
hoola cual es el soluto y el disolvente de una disolución de agua salda
Hola. El soluto es la sal y el solvente o disolvente es el agua.
Coloca el contenido de un sobre (1,6g) de café soluble (instantáneo) en una taza;agrega agua lentamente hasta la mitad de la misma y agita;esta solución será la «solucion inicial».
Luego agrega agua hasta completar el volumen total de la taza (250mL aproximadamente);esta solucion sera «solucion fina
– Indica la masa de soluto en cada una de las soluciones preparadas
– Calcula la concentracion de la solucion inicial
– Calcula la concentracion de la solucion final
– ¿Cuál de las soluciones puede considerarse concentrada y cual diluida?
– Indica en que etapa se realizó una disolucion y en cual una dilucion?
Te agradecería mucho si me pudieras ayudar,beso!
La masa de soluto en ambas es la misma, 1,6 grs de café.
concentración inicial: 1,6 grs/125 ml x 100 = 1.28 % m/v
concentración final: 1,6 grs/250 ml x 100 = 0.64 % m/v
La segunda es mdiluida comparada con la primera. En la primera una solución y en la segunda una dilución.
necesito ayuda con este problema de soluciones
prepara 200 mililitros de alcohol etílico al 5%
Hola. 5% son 5 ml de alcohol en 100 ml de solución. Asi que si queres 200 ml necesitarás 10 ml de alcohol com 190 de agua.
Necesito esta información plis
una lista de solvente polares y no plares
Hola, tanto?. Bueno el agua es el mas conocido de los polares. Algunos alcoholes también. Otros no polares son alguno solventes orgánicos como la acetona, cloroformo, etc.
biem me servira para reparar la materia quimica 🙂 100%
Ese es el gran y principal objetivo segui adelante.
Hola!, necesito hacer un trabajo en el cual me piden:
– Atracción
– Soluto – Soluto
– Soluto – Disolvente
– Disolvente – Disolvente
Y cuales serían las preguntas específicamente?. Porque así se entiende muy poco.
cómo es el soluto en una solución de disolvente generalmente diferenciado?
Hola Paula no te entiendo la pregunta.
si tengo una mezcla de 200 mililitros de agua en ebullición con 80 mililitros de azúcar y otra mezcla con 200 mililitros de agua en fusión con 80 mililitros de azúcar. ¿Cuál es el soluto y cuál es el disolvente?.
entonces ¿Cuál seria el principal elemento para desarrollar ese experimento?
El agua es el solvente y el azúcar el soluto
¿Cuál es la concentración normal de una solución que se preparó disolviendo 3 gramos de H2SO4 en suficiente agua hasta completar 100 ml de solución?
Pasa los 3 gras a moles y luego lo multiplicas por 2 ya que en un mol hay 2 equivalentes. Después lo dividis por 0,1 litro (100 ml). Ese resultado es la Normalidad.
Calcule la molalidad (m) de una solución que resulta de disolver 10 gramos de Al(OH)3 en 200 gramos de H2O.
Pasa los 10 grs a moles. Los dividis por 0,2 kgs (200 grs) y listo. Ese resultado es la molalidad.
me parecio muy importante la explicacion del profesor
osea es interesante la quimica
buenas noches mi hija estudia 3 año de bachillerato y quisiera que la ayudaran porque en realidad no entiende a su profesor aqui va la pregunta.
CALCULE LA DENSIDAD DE UN COMPUESTO CUYA MASA ES 35 GRS Y SU VOLUMEN ES DE 60 MILILITROS
DETERMINE LA MASA DE UN COMPUESTO DE UN LITRO DE QUE OCUPA UN VOLUMEN DE 2
LITOS CUYA DENSIDAD ES 1,22
espero me puedan ayudar gracias
La densidad es masa sobre volumen D = masa/V
D = 35 grs/ 60 ml = 0.58 grs/ml o grs / cm3
De la misma manera hace el otro pero hay que despejar la masa te quedará:
masa = d x V
hacelo y decime sino te sale.
me podrian correguir.
la leche es el solvente y el chocolate es el soluto.
Si
hola , una pregunta el soluto que es ?
El componente minoritario. Por ejemplo, si pones sal en agua, la sal es el soluto y el agua el solvente. Espero te haya quedado claro.
Muy buena las respuestas
hola .. 🙂 disculpa mep uedes ayudar con un ejemplo que tenga soluto liquido y solvente solido ?? x favor ¿¿¿
No se si hay Jenifer, por lo general el soluto y el solvente están en el mismo estado, no siempre claro.
a mi me gustaría saber si tiene q haber una cantidad exacta ?
siempre tiene q ser mas el gramaje del solvente q de el soluto o le puedo agregar la cantidad q yo quiera ?
Generalmente es mas el solvente.
Hola mi pregunta esque en una practica del libro me ponen que ponga si es Soluto o Solvente y el tipo de solucion pero por ejemplo 15 g de sal y un litro de agua creo que el agua es solvente y la sal soluto pero en este caso solo tengo que marcar una opción ¿Cúal seria?
La que dijistes.
disculpe buenas noches, sera que me pueda decir cuales serian las caracteristicas generales del soluto y el solvente?
No hay características especiales. Soluto es la sustancia que se disuelve en un solvente. Es conceptual
Gracias x La Información
Hola que tal,tengo un trabajo practico para entregar,quiero saber como explicar con mis palabras la expresion de concentracion de una solucion de sal en agua al 11% .Gracias
11 gramos de soluto en 100 gramos de solución. La solución tiene soluto y solvente asi que el solvente sería el agua que es el más usado. Entonces habrían unos 89 grs de agua. Esta?.
Me Ayudas Con Un Trabajo Practico?
1-Clasifica A Los Siguientes Sistemas Materiales En Homogeneo o Heterogeneo.
A. Un Vaso De Vinagre
B. Lavandina y Alcohol
C. Carbon y Azucar
D. Arena,Sal Disuelta,Agua y Piedra
2-¿Un Vaso De Agua Es Una Sustencia o Una Solucion?¿Por Que?
3-Decir Cual Es El Soluto y Cual El Solvente En La Siguiente Solucion: 4 Litros De Agua y 5 Litros De Alcohol Mezclados En Un Recipiente.
4- Que Metodos De Separacion De Fases Usarias Para Separar El Siguiente Sistema Material: Carbon,Tierra,Agua,Alcohol,Sal Disuelta y Tuercas.
POR FAVOR AYUDAA ES PARA MAÑANA
No tengo tiempo de resolverlos pero lo dejo publicado a ver si alguien te ayuda.
Me sirvió de mucho. Se ve que sábes mucho acerca de eso…
Gracias por la info
De nada Fabi, abrazo.
buena tardes me pued ayudar con este ejercicio de quimica
¿Cuál es la masa de NaOH que hay que disolver con suficiente agua hasta completar 500 ml de solución con una concentración al 3,7% m/v?
Esta fácil Leonardo, lee el post que hay varios de esos. Si en 100 ml tenes 3,7 grs de soluto en 500?.
Hola quisiera saber como se clasifican la soluciones?? Gracias
Creo que lo explique en el post
si tengo20 ml de alcohol(0,785g/ml) mezclado con 250ml de agua(1g/ml)y 15g de hierro …..como saco %m/m de la solución?
Quien me ayuda a hacer mi guía de química está uff que no acabo es urgente es mañana son 90 preguntas que tenía que hacerlas en ojas de máquina ya conteste 30 pero las demás no las ayo
hola buenas noches me pueden ayudar con una tarea porfa
como ralizo la formula.
cual es el punto de ebullicion normal de una solucion de sacarosa C12H22O11, 1,25m sabiendo que K del agua es 0,512 grados centigados sobre mol
Buenas tardes Quimico
Cuantos gramos de pergamanato de potasio y agua, tendrán 320 gramos de solución con una concentración de 6,4 % m/m.
Cuantos gramos de pergamanato de potasio y agua, tendrán 320 gramos de solución con una concentración de 6,4 % m/m.
Primero estudia la teoría y vas a entender después como se hace cualquiera de este tipo de ejercicios. Entra a este post que para eso lo escribí.
http://www.quimicayalgomas.com/quimica-general/estequiometria-y-soluciones-quimicas/soluciones-quimicas/
Cada estudiante describirá 3 soluciones químicas donde describa cual es el soluto, solvente.
calcular el porcentaje de masa a masa , al disolver 4,7 gramos de amoniaco en 890gramoas de agua,
si desea preparar en el laboratorio1250 centimetros cubicos de disolucion de cloruro de sodio en una concentracion de 2,8g/L.que cantidad de cloruro de sodio debemos disolver en el agua
Entra a este post yeny para entender y podrás hacer ese tipo de problemas.
http://www.quimicayalgomas.com/quimica-general/estequiometria-y-soluciones-quimicas/soluciones-quimicas/
Interesante todo esto pero lo que necesito sabes es Como están constituidas las composiciones de las soluciones
Por qué las interacciones que se dan entre soluto-soluto, disolvente-disolvente y soluto- disolvente, son importantes para determinar hasta qué grado se disuelve un soluto en un
disolvente? como se explica eso?
Es lógico Luis. Si hay rechazo entre las moléculas no se podrá disolver un soluto o una sustancia en otra.
hola soy estudiante te ingenieria metalurgica me plantean este problema ¿cuantos gramos de yodo deben disolverse en 725ml de disulfuro de carbono,cs2(d=1.261)para obtener una disolucion o,236m
m podria ayudar xfavor
Hola Sandra por razones de tiempo no resolvemos problemas.
Hola buenas , pregunta , si tengo 96% de alcohol y un 4 % de agua cual es el soluto y el solvente?? Desde ya muchas gracias!!
soluto el agua
Buenas tardes Patricio, soy una mamá que estoy ayudando a mi hija de 11 años con un trabajo práctico y realmente necesito ayuda, si puede me contesta y si no gracias igual.
Le piden ejemplo de soluciones que cumplan con los siguientes requisitos:
– Solución Acuosa: VINAGRE
– Solución en la que el solvente no sea agua: TINTA Y ALCOHOL.
– Solución con tres solutos sólidos: ACERO INOXIDABLE
– Solución con dos solutos sólidos y uno líquido: CAFÉ SOLUBLE AZÚCAR Y AGUA
– Solución sólida: ACERO
– Aleación: BRONCE
– Solución gaseosa: AIRE
Esas son las respuestas que escribimos.
Entiendo que para usted es muy básico esto, pero para mi es complicado.
Muchas gracias.
Lo veo correcto, besos.
Me pueden ayudar en esta??Segun la cantidad de soluto y del solvente presentes en una solucion cuantos tipos de solventes podemos tener?
Los tipos de solventes no se diferencian por las cantidades.
hola una explicación, no le entro a este ejercicio si se mezclan 400 ml de solucion acuosa de carbonato de calcio al 10% en masa y una densidad de 1,1 g/ml. ¿ cual sera la concentracion de masa sobre masa?
Esta contestada. 10 %. No será otra la pregunta?.
Buenas tardes, me piden que de un ejemplo de soluto liquido, solvente liquido, soluto solido, me puede ayudar, muchas gracias,
agua alcohol y sal.
Buenas noches necesito saber como se llama el cambio de estado del solvente al soluto
Ese cambio no existe.
¿¿ porque se separan los componente de una solucion ??? — ejemplo — en partes iguales – aceite ( lubricante ) – alcohol isopropilico – acetona – gas-oil – y tiner — al cabo de unos rato se separa tengo ke agitarlos para ke se mesclen y despues otra ves se separan — gracias por responder
Hola Luis. Se separan porque son inmiscibles o no miscibles. Típico ejemplo es el agua con el aceite. Cuando entre ellos son miscibles es porque hay entre ellos compatibilidad química. Por ejemplo que ambos sean polares.
como puedo hallar la cantidad de solvente en una solucion, si solo tengo la cantidad del soluto y la solucion
A la masa de solución le restas la masa de soluto y listo. Esa es la masa del solvente.
Me Ayudas Con Un Problema
¿Cual?
Que masa de solito y de solvente se requieren para preparar 200 gramos de cloruro de solución de sodio al 4,5% p/p
Me Ayudan ?
Ese % te dice que en 100 grsmos de solución tenes 4,5 grs de cloruro de sodio. Así que si queres preparar 20 grs de solución tendrás que usar el doble de soluto, o sea, 9 grs.
Quisiera saber como se relaciona el estado fìsico de un soluto y del solvente con el estado fìsico de la soluciòn
Es una pregunta amplia. En realidad el estado físico de un soluto puede ser el mismo o distinto del estado del solvente o de la solución. Por ejemplo sal en agua. La sal es sólida y el agua líquida. Más que nada importa si el soluto es soluble o no en ese solvente.
En este ejercicio, El jarabe de maple tiene una densidad de 1.325g/ml y 100 g de jarabe de maple contiene 67 mg de iones Ca 2+ . Calcular las ppm y la molaridad de la solución.
El Calcio es el soluto? o el solvente?
Por la escasísima cantidad obviamente es soluto.
Determina el soluto y el solvente en las siguientes mezclas:
-Agua con sal :
-Sal con azúcar
-Arena y rocas
-Leche con chocolate
500 ml de agua con 20 g de sal disueltas (vol solución: 500 ml). cual es el soluto y cual es el solvente ¿porque?
La sal es el soluto porque esta en menor cantidad.
Si nos recomiendan utilizar soda caustica al 50%m/m para destapar un drenaje, ¿Cuántos gramos de agua y de NaOH se deben usar?
está bien formulado? y, me ayudas por favorrr
Primero hola. 50 y 50.
Gracias Químico buen día si quiero determinar la normalidad me dan los gramos de soluto y me dan los litros de Agua puedo tomar ese volumen de agua directamente para el calculo o debo convertir a volumen de solución? Muchas gracias
Hola Andrés. Generalmente toman el volumen del agua como el volumen de solución. Igual eso lo debería aclarar tu profesor.
hOLA, UN SALUDO ESPECIAL: Solicito de usted la solución a este problema de soluto y solvente. podría:
Calcula el % m/v de una solución que se preparó con 15 gramos de soluto disueltos en 90 ml de solución.
Hola José. Fácil. Seguí lo que dice la fórmula. %m/V = (masa soluto/Vol solución) x 100
15/90 x 100
Hola Soy Veronica. Necesito resolver este problema: un asistente quiere preparar dextrosa agar. La sustancias serán disueltas en agua destilada para hacer 500 ml de solución. Las sustancias son: dextrosa 5 g, triptosa 8 g, sodio 25 dg y agar 7500 mg. Cuál es la masa total de los ingredientes disueltos? gracias!
Hola Vero. Sumalos y listo. No resiste más análisis.
hola amigo me podria responder esta pregunta: si una solucion es soluto y solven y si se disuelven 30 gramos de azucar en 100 gramos de agua cuales son los gramos de solucion que se forman
Los sumas. 130 g
Hola! Puede haber más soluto que solvente?
Hola. No. El solvente por definición es el componente mayoritario.