La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua.
La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
HCl + NaOH —-> NaCl + H2O
En este caso vemos al ácido clorhídrico contra el hidróxido de sodio. Genera cloruro de sodio y agua. En este caso basta una molécula de ácido con una molécula de la base para generar la sal. Pero no siempre es asi.
2 NaOH + H2SO4 —-> Na2SO4 + 2 H20
Aquí se necesitan 2 moléculas de la base contra 1 del ácido para formar el sulfato de sodio.
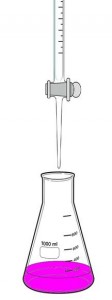
Este principio se usa para averiguar la molaridad de un ácido o de una base gracias a un procedimiento llamado valoración acido base o titulación acido base. Por ejemplo, si se quiere averiguar la molaridad de un ácido se coloca a la solución de este en un erlenmeyer y se la enfrenta con otra solución de un hidróxido de concentración excatmente conocida. Esta solución de la base se la coloca en una bureta quedando por encima del erlenmeyer que tiene la solución problema del ácido. Colocamos una gota de un indicador en el erlenmeyer para que nos indique el momento exacto en el cual se ha producido la neutralización, o sea, cuando no haya exceso de base ni ácido, por ejemplo la fenolftaleína. Dejamos caer gota a gota desde la bureta al Erlenmeyer haciendo movimiendos suaves y circulares para una correcta titulación. Apenas vemos un cambio de coloración al rosa cesamos al agregado de la solución de hidróxido de sodio. Medimos el volumen agregado de la solución de NaOH y hacemos los cálculos correspondientes.
Ejemplo: Se consumieron 60 ml de NaOH 0,4 M contra un volúmen de H2SO4 en el erlenmeyer de 100 ml.
Los moles agregados de NaOH son:
0,4 M x 0,060 litros: 0,024 moles
Según la reacción, la cantidad de moles de NaOH es el doble del H2SO4: Entonces de H2SO4 habrán 0,012 moles. La molaridad de H2SO4 será:
M = 0,012 moles / 0,1 litro (100 ml)
M = 0,12 M
Si tienes inconvenientes para resolver trabajos prácticos o necesitas prepararte para las evaluaciones te ofrecemos nuestro servicio online de clases o tutoriales a un costo accesible. Consulta a:
Hola muy buena explicación,me gustaría saber como calcular cuántas moléculas se necesitan en el balanceo de la ec…
que ecuación?
Hola, me gustaría saber qué puedo hacer en este ejercicios: ¿Qué volumen de ácido fosfórico del 90% de pureza y densidad 1,88 ml se debe tener para preparar 400 ml de solución 0,6N?
Hola Sofi he escrito en este post que te doy a continuación ejercicios así. Entra y mira el problema 6.
http://www.quimicayalgomas.com/quimica-general/estequiometria-y-soluciones-quimicas/soluciones-quimicas/
Existe alguna tabla de neutralización ácido-base?
Gracias.
Saludos!
No creo.
qué tal me podría ayudar dando un ejemplo sobre de importancia industrial y un ejemplo de importancia clínica o biológica
Hola Axel. En nuestro organismo como en la sangre es fundamental mantener el pH adecuado. Es 7,35 así que si bien no es exactamente 7 no debe haber excesos de ácido o base.
facil
Muchas gracias!
Profesor me puede ayudar con un problemita:
Que volumen de H2SO4, 0,2 M, es necesario para neutralizar completamente 20mL de Ca(OH)2 0,1M
Tenes primero que hacer la reacción, plantearla. Verás que 1 mol del ácido neutraliza a 1 mol de la base. Por lo tanto:
M1 x V1 = M2 x V2
Despejas V del ácido y listo.
Hola maestro tengo una duda acerca de la neutralización
Lo
Hola. ¿Cuál?.
Hola Profesor
Me permito hacerle una pregunta a ver si usted me puede ayudar, es que tengo un tanque de nafta el cual esta oxidado por dentro, me han dicho que lo tengo que lavar con ácido fosfórico, pero luego al quitar el ácido debo hacer una limpieza para neutralizar dicho ácido. ¿Que producto puedo utilizar como base para neutralizar y enjuagar dicho ácido que se pueda conseguir fácilmente en tiendas?
Saludos.
Hola Roberto, sinceramente no lo se. Tendrás que averiguarlo preguntándoselo al mismo comerciante.
hola
Hola como estas
Puedes neutralizar con hidróxido de potasio
Bueno todo depende de la concentración de ácido fosfórico estés manejando y mucha razón tienes q saber las especificaciones de tu proveedor de químicos
Hola, que tal profe!
Tengo varias dudas de algunos problemas, espero me pueda ayudar con algunos, y son los siguientes:
1.-Se tienen 50 ml de solución de NaOH con un pH = 12. ¿Cuántos mililitros de solución 0.05 M de HCl se requieren para neutralizar la base?
2.-La fermentación es un proceso químico complejo que se utiliza en la manufactura de los vinos, en el que la glucosa (C_6H_{12}O_6) se convierte en etanol (CH_3CH_2OH) y dióxido de carbono (CO_2):
C_6H_{12}O_6 \rightarrow 2 CH_3CH_2OH + 2 CO_2
Si se empieza con 500.4 g de glucosa, ¿cuál es la máxima cantidad de CO_2, en gramos, que se obtendrá por medio de este proceso?
Las masas molares son: C 12 g/mol; O 16 g/mol; H 1 g/mol
3.-La masa atómica promedio del boro es de 10.811016 uma. Las masas de los isótopos de procedencia natural son: 10B = 10.0129 uma y 11B = 11.0093 uma. Calcular la abundancia porcentual del 10B
4.-Cuando el benceno (C6H6) reacciona con bromo (B2) se obtiene bromobenceno (C6H5Br):
C_6H_6 + Br_2 \rightarrow C_6H_5Br + HBr
En cierta reacción se utilizan 30 g de benceno y 65 g de bromo. Si el rendimiento real de bromobenceno fue de 50 g calcular el porcentaje de rendimiento de la reacción.
Las masas molares son
C 12 g
H 1 g
Br 79.9 g
Hola. Bueno a ver. Si el pH es de 12 el pOH es de 2. Por lo tanto la concentración de [OH] es de 10 a la menos 2. Sabiendo la [OH] sabes la del NaOH ya que es una base fuerte. Aplicando una fórmula.
Ma x Va = Mb x Vb
molaridad por volumen de acido es igual a molaridad por volumen de base.
Va = Mb x Vb / Ma
Va = 0,01 M x 5o ml / 0,05 M
Va = 10 ml
Por razones de tiempo no puedo hacer todos los problemas. Imaginate si todos me pidieran algo asi, jaja. No es le caso. Abrazo
Aun asi, muchas gracias! 🙂
Hola tengo un ejercicio que no puedo resolver. Se mezclan 25ml de H2SO4 0,12N con 15ml de HCl. Para neutralizar se utiliza 40ml de KOH 0,35M . Cual es la concentración de HCl?
Hola Viky sabes que ya no respondo este tipo de problemas por falta de tiempo. Aca tenés una base fuerte contra acidos fuertes y de lo q se trata es de que la cantidad de equivalentes del ácido se neutralicen con la misma cantidad de eq de la base. Asi que los eq de KOH los sacas fácil. 0,35 M x 40 ml = 14 milieq.
Debes tener también 14 de ácido en total. De H2SO4 tenés 25 ml x 0,12 N = 3 milieq así que 14 – 3 = 11 milieq de HCl. Con esto y el V = 15 ml sacas la N de HCl. Espero te haya servido besos.
hola a ver si me puede ayudar:
como preparar soluciones 0,1 molar de NaOH para titular soluciones acidas de concentracion desconocida
Titulacion: Neutralizacion acido base
materiales a utilizar
debes pasar 0,1 moles a gramos. masa = 0,1 moles x 40 grs/mol = 4 gramos. Que sea lo más puro posible y lo diluis con agua destilada hasta un litro. De todos modos para saber su concentración exacta debes titularlo con un patrón conocido. Patrón primario.
Por favor se dicen cual es el nombre de estado ecuación 2Na OH+H2 SO4
Tu pregunta apunta a que se obtiene como producto cuando reaccionan?.
Profesor por favor que pasos debo seguir para neutralizar el xilene cianol.
Muchas gracias
No lo sé. Ojalá alguien lo sepa y participe
cuanto ácido clorhídrico (ml) hay en una disolución de 29ml de bicarbonato de sodio??
Esta pésimo el enunciado. Faltan datoa y la relación entre esas dos sustancias o por lo menos la reacción química
Hola, tengo una duda respecto a las titulaciones ácido base, sobre todo en la de ácido débil- base fuerte . La neutralización se produce cuando las moles de NaOH se igualan con las de CH3COOH. Eso quiere decir entonces que ambos compuestos se van a neutralizar también cuando ambos tengan el mismo volumen o no necesariamente??? Gracias.
No necesariamente el mismo volumen sino como dijistes al principio el mismo numero de moles como lo indica su reacción química entre ambos. Los volumenes usados dependerán de sus concentraciones iniciales
buenas tardes tengo una pregunta
tengo un producto acido con pH 0 y que segun su hoja de seguridad los componentes son acido clorhidrico %23, 2-butoxietanol %4 y acido fluorhidrico %7 y lo quiero neutralizar
la hoja de seguridad dice que lo neutralice con cal (CaO), y quiero saber que voy a obtener como resultado de la neutralizacion
hice una prueba usando 600 ml de producto y 65 mg de cal (CaO) diluidos en 500 ml de agua obteniendo pH7 pero no se que resulto de esto
si me pudieras ayudar en esto te lo agradecería mucho para darle una buena disposición a los residuos que resulten de esto
Hola, si llegastes a pH 7 ya resolvistes el problema.
Por qué a un ácido se lo neutraliza con una base
porque son antagonistas. Uno porta protones (el ácido) y el otro oxhidrilos ( la base).
Disculpe que es lo básico de química en nivel preparatoria, se conectan con otras ciencias en particular?. gracias!
Depende los programas de estudio en los diferentes países.
Disculpe profesor, me puede explicar cuáles son las aplicaciones que tiene él proceso de neutralización acido – base?
Es una pregunta muy amplia. Pero por ejemplo en nuestra sangre debe haber un equilibrio perfecto de pH que oscila entre 7,35 a 7,45 gracias a que esta estabilizado por un sistema especial. Pero si sale de ese rango esta comprometida nuestra vida. Asi que imaginate lo importante que es el equilibrio acido base. En los alimentos también por ejemplo cuando están alterados o descompuestos el pH esta también alterado.
hola patricio amplio con mis palabras que sabes mucho sobre el tema ya que es algo muy amplio y complicado pero necesito saber una solucion casi igual a la de este blog podrias ayudarme?
Depende que tengas.
ola k tal me pidieron que sacara la sal y el agua y que la balanciara es esta formula NaOH + H2So4 porfa lo necesito gracias saludos
2 NaOH + H2SO4 —> Na2SO4 + 2 H2O
Hola!
Quisiera saber por qué algunos textos recomiendan que cuando el volumen a titular es muy pequeño, se puede aumentar agregando agua destilada, visualizando mayor la determinación del punto final de valoración, sin que ello afecte la concentración de la solución a determinar… Porqué no se ve afectada?
y otra cosa si tuviese un matraz erlenmeyer limpio pero húmedo para vaciar por ejemplo HCl medido con la pipeta aforada en una titulcación. Cómo afectaría esto a la solución? Y como afectaría si la punta de la bureta tuviese burbujas.
Desde ya gracias 😀
Con respecto a la primera pregunta es lógico, si tenés poca muestra la diluis para trabajar mejor. Después los resultados los corregís multiplicando por la inversa de la dilución. La segunda pregunta no te la entendí.
Mi humilde opinión respecto al la segunda pregunta.
Creo que en ambos casos obtendrían volúmenes falsos en la titulacion, ya que en el primer caso ya tienes una pequeña cantidad de agua en tu matraz y en el segundo caso tu volumen de la buena no es exacto por el aire contenido en la punta.
Un saludote.
Dice: buena
Debe decir: bureta
Buenas tardes Profesor ;
La pregunta es, al fermentar fruta con melaza y agua, como se puede detener el proceso de fermentacion antes de que se convierta en vinagre, ya que la intencion es obtener las propiedades de la fruta en fermentacion tanto en liquido como en solido, gracias y saludos.
Hola publicare tu pregunta y esperemos que algún experto en este tipo de procesos te ayude fausto. Exitos
una neutralizacion o valoracion es?
Proceso mediante el cual ácidos y bases se unen entre si para formar la sal. Valoración es la medición de los volumenes usados de ambos para realizar diferentes cálculos de cantidades
Buenas noches profesor, mi pregunta es la siguiente:
¿En qué tipos de procesos se aplica la neutralización ácido-base, y el calor asociado a estos procesos?
Desde ya le agradezco por su respuesta, es para una tarea de la universidad 🙂
Hola. En muchas reacciones químicas, las de ácido base. En nuestra sangre hay una constante neutralización de ácidos y bases para mantener el equilibrio acido base.
Estimado quisiera consultarle una duda que tengo en mi proyecto. Luego de una lixiviación genero agua residual de pH=3 que cantidad de cal debería utilizar para neutralizar 1883,69Kg/h de la solución antes de su disposición final?
Hola Cynthia, no lo sé. Dejemos que algún experto opine. Besos.
Hola buenas tardes, me puede ayudar a resolver un problema?
La acidez del estomago equivale aproximadamente a una disolucion de HCl 0.02M ¿Que volumen de este acido se neutralizara con 150 mg de un antiacido que contiene 60% de carbonato de sodio?
De antemano muchisimas gracias!
Hola, te ayudare pero vos lo resolveras.
Molaridad = moles soluto / volumen solución.
En el caso de la neutralización la cantidad de moles de HCl será igual a la del antiácido. Asi que calcula la cantidad de moles de carbonato de sodio (Na2CO3) para igualarla a los de HCl. Como moles = M x V
moles de CO3Na2 = Ma x Va
Ma = molaridad del ácido (0,02M
Va = volumen que debes calcular.
con los 150 mg y ese porcentaje calcula los moles de la sal.
hola, es posible utilizar la energía eléctrica como indicador de la neutralidad de una solución? si o no y porque?
Si pero no recuerdo el nombre del dispositivo. Son electrodos que registran el cambio de pH.
BUENAS ME GUSTARÍA SABER ¿CUAL ES LA SUSTANCIA QUE PUEDE NEUTRALIZAR LOS ÁCIDOS?
——-GRACIAS POR SU ATENCIÓN¡¡—-
ESTA MUY BUENA LA PAGINA…????
Los hidróxidos o bases.
Hola profesor buenas tardes. Una pregunta relacionada en cuanto a términos de éste tema. Entonces ¿ cuáles vana ser las diferencias entre la neutralización y la titulación ?
Titulación es el proceso de medición para llegar a la Neutralización
Disculpen me podrían ayudar con ejercicio:
cuantos gramos de Carbonato de sodio, se ocuparían para titular 10 ml de una solución de ácido clorhídrico de 0.05 molar
¿Al producirse una neutralización hay un equilibrio?
Gracias por la información previa.
Exacto Lauri.
Buenas tardes profesor mi ´pregunta es si tomamos hidroxido de sodio y le aplicamos fenolftaleina y mas tarde le aplicamos acido sulfurico que pasa?
muchas gracias espero su respuesta
En medio básico la fenolftaleína hará color rosado pero con el agregado ácido hará virar a incoloro cuando llegue le punto de neutralización.
Hola una pregunta el Carburo Fosfuro mercurioso se puede neutralizar y quedar 0?
Hola. Tenés la formula de ese compuesto que jamás escuche?. Jaja.
hola profesor
no entendí del todo , al principio lo sabia pero ya como en la mitad ya me perdí y lo leí dos veces y aun sigo sin entender , mañana tengo un control, pero con la recepcionista que mando ella , no se le entiende nada.Pero me gustaría saber en general que es la neutralización para que sirve y ejemplos, y las características de ácido base.
gracias!
o que se esta en el post Karla. Cualquier cosa te dejo mi mail para el servicio de clases o resolución de trabajos prácticos. Este servicio tiene un costo.
[email protected]
Buenas, mi nombre es Horacio y quiero preguntarte con que se puede neutralizar el ácido que tienen los acumuladores de auto, y si despues de neutralizarlo, se puede desechar a la alcantarilla?. Gracias.
Nosé Horacio la química de los automóviles.
hola me gustaría saber ¿Qué sustancia se utilizaría, si se vierte una considerable cantidad de un ácido o una base para neutralizar su efecto?
Se neutralizan entre sí. Las cantidades de uno dependen de las cantidades del otro.
Hola, quisiera saber cuales son las funciones del organismo, con respecto a la neutralizacion
No se entiende la pregunta. Podrías ser más específico?.
hola necesito sacar la molaridad de la Solución 0,74% p/v de Na2SO4.2H2O. densidad: 1,01 g/mL
Aca es complicado explicar esto. Visita mi artículo de Soluciones Químicas y verás problemas muy similares.
Falto indicarte 0,5 N del acido
En que?
Hola Patricio, como calcula la N de 35 ml de Na(OH) que se neutraliza con 15 ml de HCl 0,5 N Gracias
Hacelo con la fórmula N1 x V1 = N2 x V2
O sea de un lado está el ácido y de la otra la base. Despejas la incógnita en este caso la N del ácido y ya esta.
Hola .. Saludos
Profesor una pregunta
Como calcular el peso equivalente del acido fosforico para el caso de neutralizacion completa
Hola Rossy querida. Dividi el peso molecular por 3 ya que tiene 3 hidrógenos si es el PO4H3
Muy interesante información
Gracias y éxitos.
ok
hola, me puedes ayudar con lo siguiente: tengo un tanque de 3000 litros preparados de hidroxido de sodio se le agregaron 3 cubetas de hidroxido de sodio liquido al 50 % de concentracion, del tanque tome una muestra del cual agregue a un vaso de presipitado 1 mililitro con 100 mililitros de agua destilada, lo titule con un acido ( acido sulfurico al 1 normal, le agregue fenolftaleina y me gasto 0.6 mililitros de acido , como puedo saber que concentracion tiene el tanque ?
Saludos.
Antonio como estas. Por razones de tiempo no resolvemos problemas extensos. Por lo tanto debemos cobrar ya que nos lleva mucho tiempo.
Profesor yo tengo una enorme duda, si tengo 400 kg de NaOH cual seria la cantidad de HCl necesaria para neutralizar los residuos utilizando la primera ecuación? ( NaOH + HCl → NaCl + H2O)
Esta balanceada la reacción es sencilla. Mira, parti de la base de que un mol de HCl se combina con un mol de NaOH. Así que pasa los 400 kg o 400.000 grs de NaOH a moles y serán los mismos moles de HCl entonces, después pasas los moles de HCl a gramos y listo
Buenas tardes profe, usted podría decirme en que pagina de internet encontrar libros donde tenga la siguiente informacio:
Definición de pH, Calvulo de pH, escala de pH
Que es acido, base, Bases fuertes, y débiles,
Neutralización.
todo relacionado con la agronomía (agroquímica)
Hola Juan. De agronomía específicamente no.
hola buoas dias, tengo un a pregunta basa en neutralizacion. si tengo 10gr de NaOH y las hago reaccionar con 10 gramos de acido lactico. ¿como determino el peso de la sal que producen?
si me puedes ayudar quier saber como neutralizas al c5h4n4o3 trioxipurina y si se puede neutralizar en el aire
Hola Jaime. Perdoname pero no conozco ese compuesto.
Buenas tardes, excelente artículo! tengo una duda la cual es la siguiente: Cuanta base de bicarbonato de calcio necesito para neutralizar 100 lt de ácido láctico.
Hola Vale querida. Depende de las molaridades o de las normalidades del ácido y de la base
Buenas.
Estoy estudiando las curvas de valoracion acido-base y me ha surgido una duda al ver esta cuestion
¿no se tendria que tener en cuenta en el volumen final los 100 ml del erlenmeyer mas los 60 ml del NaOH añadidos desde la bureta?
Hola. NaOH frente a que ácido?. Completame los datos o que ejercicio quieres ver.
Hola, quería saber si me podría ayudar en este problema:
«Calcule el volumen de ácido sulfúrico al 94% (m/m) y d= 1,84 g/ML necesario para neutralizar:
A) 1,53×10*23 molécula de hidroxido de sodio
B) 25ml de hidroxido de magnesio 0,2N»
Desde ya agradecería su ayuda
Hola Juana por razones de tiempo no hacemos problemas tan extensos. Tenemos el servicio aparte de realización de ejercicios pero es pago.
buenas noches me puedes colaborar con esta pregunta
que cantidad de hidróxido de sodio se requiere para neutralizar 30 mililitros de ácido clorhídrico?
Te falta el dato de la molaridad o normalidad del ácido.
Hola me podria ayudar con una pregunta experimental
Es como una explicacion del por que para neutralizar un acido débil se utiliza una misma cantifad de base fuerte para el ácido fuerte y para el débil
Hola. Lo que se neutraliza es la cantidad de moles de un ácido con una cantidad que podría ser igual de una base. Depende de la ecuación balanceada de neutralización.
hola no se si aun respondes estas preguntas… pero ahí te van mis dudas
como seria la ecuación química (balanceada) del Ácido clorhídrico con el Azul de bromo timol
como seria la ecuación química (balanceada) del agua de cal + fenolftaleina + el ácido clorhídrico
Hola. Los indicadores no figuran en las reacciones.
Hola buenas tardes, me gustaria saber que métodos aparte del volumétrico existen para determinar la concentración de un ácido. Muchasa gracias ES SUPER URGENTE PORFAVOR SOLO RESPUESTAS SERIAS.
No se me ocurre otro. Conductimetría quizá. Pero averigua en google.
Hola buenas tardes me podría ayudar no se resolver este ejercicio:
Se agregan 60 [mL] de una solución de NaOH 0,12 M a 60 [mL] de solución de ácido acético (HC2H3O2) 0,12 M (Ka = 1,8 ∙ 10-5). Calcule el pH de la solución final.
Hola. Es una resolución larga. No lo hacemos por aquí.
Buenas tardes Profesor,
Quisiera saber que reacción tiene lugar al mezclar H2SO4 en agua de mar, donde podríamos decir que la sal más abundante es NaCl. Luego, como debería hacer para conocer el pH final si mezclo X ml de agua de mar con X ml de H2SO4. Que datos debo conocer para poder determinar el pH final?
Gracias!!
No es muy clara la pregunta. Deberías verlo en un enunciado concreto. El agua de mar es teóricamente neutra. No le veo sentido que le metas sulfúrico. Si no hay hidróxidos en el agua prevalecerá el ácido. Sin enunciado no es nada claro lo que me preguntas.
Profe este ejercicio no me sale : Se tiene 500 ml de NAOH de concentracion molar desconocidda, se neutraliza completamente con 20 ml de HCL 0,5N y 4,9g de H2SO4. Cual es la molaridad del hidroxido?
dato: P.M H2SO4:98
Hola Luis. Tenes que calcular la cantidad de moles totales de lo ácidos. En el caso de HCL la relación es 1 a 1 con la base pero con el ácido sulfúrico es 2 a 1 o sea, 2 moles de NaOH neutralizan 1 del ácido. Así que la cantidad d emoles de NaOH será la cantidad de moles de HCL más el doble de los moles de ácido sulfúrico. Esos moles los dividís por 0,5 litros y te da la M.
Hola, no sé si aún respondas preguntas, pero tengo una duda para un informe de laboratorio. En la práctica de laboratorio hicimos una reacción de neutralización entre ácidos-bases, y medimos su entalpía de neutralización con un calorímetro, también la temperatura que tuvo la reacción con un termómetro y observamos que, la reacción entre Acido nítrico (H03-Acido fuerte) y la base Hidróxido de sodio (NaOH-Base fuerte) obtuvo mayor temperatura cuando la concentración del ácido y la base eran iguales (0,50M y 1mL), pero también se obtuvo una temperatura muy similar entre el Acido acético (acido débil) con la misma base NaOH, y ambas tenían la misma concentración y cantidad. Entonces mi pregunta, como tal es ¿a qué se debe que una reacción de neutralización tenga más temperatura cuando las concentraciones y cantidades de los reactivos son iguales?, ¿tiene que ver si son fuertes o débiles o es coincidencia?
Hola Lina. Posiblemente porque no quedarían reactivos en exceso.
Buenos días , que temperatura máxima alcanza la reacción de acido sulfúrico concentrado con una solución de hidróxido de sodio al 30% ?? ( reacción de neutralización )
Saludos.
No lo sé Luis. Es una pregunta muy específica. Deberías hacer la experiencia y medirla. Si alguien tiene el dato capaz conteste.