Los ácidos fuertes son aquellos que se disocian (se separan en iones) totalmente. Al contrario de los débiles. Aquí te explicaremos como es el proceso de formación de un ácido fuerte. Básicamente hay dos tipos. Los Oxácidos y los Hidrácidos.
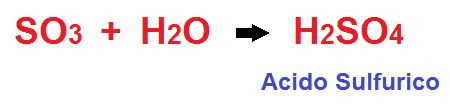
En los oxácidos la reacción de formación es la combinación entre un óxido ácido y el agua.
Veremos como ejemplo la formación del ácido nítrico (HNO3). El primer paso consiste solamente en sumar los átomos de cada elemento de ambos compuestos, óxido y agua. Como vemos, si contamos obtenemos en total 2 de H 2 de N y 6 de O ya que son 5 átomos de O en el óxido y 1 en al agua.
N2O5 + H2O –> H2N2O6
Pero a esta molécula la debemos simplificar (si se puede) para obtener la fórmula real del ácido. En este caso dividimos por el 2 a cada número que indica la cantidad de átomos de los elementos.
H2N2O6 –> HNO3
La reacción final balanceada de la formación del ácido nítrico queda entonces así:
N2O5 + H2O –> 2 HNO3
Pueden observar que se coloco el coeficiente estequiometrico 2 adelante de la molécula del ácido para balancear. Esto fue necesario por la simplificación anteriormente explicada.
Para el caso de los Hidrácidos la reacción es más sencilla aún. Solo tienes que combinar a un no metal con el hidrógeno. Ejemplo.
Formación del ácido clorhídrico.
En estos casos como en la formación de cualquier compuesto binario (dos elementos). Primero intercambiamos las valencias de los elementos que reaccionan. El H2 tiene valencia 1 y los no metales en los hidrácidos siempre utilizan la menor valencia, este punto es importante que lo recuerdes. Sabemos que el cloro bromo y Iodo poseen varios números de valencia o estados de oxidación (1,3,5 y 7). Justamente aquí usarán la 1 que es la menor porque están formando hidrácidos. En cambio en los oxácidos pueden usar cualquiera de las mencionadas. Volvamos a nuestra reacción. Intercambiamos entre el cloro y el hidrógenos las valencias 1.
Cl2 + H2 –> H1 Cl1
Los números 1 los podemos quitar ya que no hace falta ponerlos. Cuando vemos un átomo nos está diciendo que es uno solo. Ahora por último solo balanceamos y listo.
Cl2 + H2 –> 2 H Cl
Otro ejemplo es el ácido sulfhídrico. Aquí el azufre actúa con la valencia 2 que es la menor.
S + H2 –> H2S En este caso no es necesario el balance.
Espero que te haya resultado útil este post. Deja tus comentarios. Éxito.
Si quieres tener una buena Base en Química para cualquier nivel de estudio. Te recomiendo que mires este Libro de Química. Con Teoría y Ejercicios resueltos. No te lo pierdas.
Bases de Química General
Profesor y Bioquímico: Patricio Arroyo.
