Básicamente existen dos tipos de electrolitos. Los fuertes, que son aquellos que se disocian o se ionizan en un 100 % y los débiles que lo hacen en un grado o porcentaje muy bajo. Hoy hablaremos de estos últimos representados por los ácidos y bases débiles.
Cuando se habla de ácidos fuertes, bases fuertes y sales la disociación es muy sencilla. Pero en el caso de las sustancias débiles debemos usar la famosa constante de disociación. Este no es ni más que un ejemplo de equilibrio químico en la cual la constante expresa la relación matemática entre el producto de las concentraciones de las sustancias a la derecha de la reacción, elevadas a sus coeficientes estequiométricos sobre el producto de los reactivos elevados también a sus coeficientes. Como sabemos, el agua es el solvente más usado y lo tenemos en cuenta como participante en las reacciones de ionización de ácidos y bases débiles. Veamos algunos ejemplos.
Acido acético (CH3 COOH)
Es un ácido débil y monoprótico, o sea, aporta un H+ por molécula. A veces por razones de practicidad se usa la notación (AcH) reemplazando al anión CH3COO- por Ac-. La reacción de AcH con agua queda:
AcH + H2O <—> Ac- + H3O+
El H3O+ es el ión hidronio que es el que define el pH. pH = – log [H3O+]
La constante será:
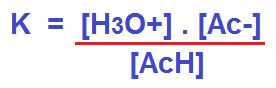
El valor de esta K oscila en 1,8 x 10-5 (1,8 x 10 a la menos 5). Esto significa que el denominador es muy superior en concentración a las especies del numerador. Nos indica que hay muy poca tendencia de esta reacción hacia la derecha, se disocia muy poco. Por este motivo es un ácido débil. Los valores de las constantes solo varían con la temperatura.
Otro ejemplo es la base débil amoníaco (NH3).
NH3 + H2O <—-> NH4+ + OH-
Como podemos ver, genera iones oxhidrilos (OH-). Sin embargo como lo dice el valor de su K que es el mismo que el del ácido acético.
En muchos problemas de cálculo de pH nos piden que calculemos el pH de soluciones de cierta concentración de estos ácidos y bases débiles. Para estos cálculos es fundamental tener el valor de K y la concentración inicial de la sustancia. No es el objetivo de este artículo pero veamos un ejemplo.
Calcula el pH de una solución de ácido acético de concentración 0,2 M.
AcH + H2O <—> Ac- + H3O+
Ka = [Ac-] x [H3O+] / [AcH]
Debemos plantear el inicio y el equilibrio a partir de la concentración inicial de este ácido.
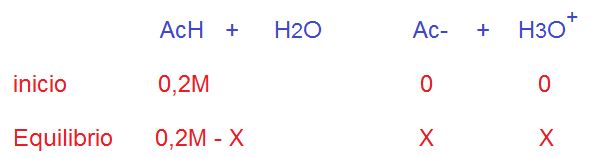
Al inicio no se forma aún iones Ac- e hidronio. Después en el equilibrio si se forman cantidades equitativas y desconocidas de los iones formados a la derecha de la reacción.
Si planteamos de nuevo la K de equilibrio quedaría:
Ka = (X . X) / [AcH]
Ka = X² / [AcH]
Donde X será el término que debemos despejar ya que ahí sabremos la [H3O+]
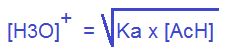
Este resultado nos arroja el valor de 0,0019 M. Y el pH da 2,72.
Si te gusto el artículo deja tus comentarios. Un abrazo y hasta pronto.
Bioquímico y Profesor: Patricio Arroyo.
www.quimicayalgomas.com
