Los elementos químicos en la Tabla periódica están ordenados como ya sabemos por su número atómico. De hecho sus propiedades son funciones de su número atómico. Esto significa que el aumento o el descenso de una determinada propiedad esta relacionada con el orden de los números atómicos. Con respecto a las propiedades periódicas de los elementos específicamente hablaremos aquí de las más importantes.
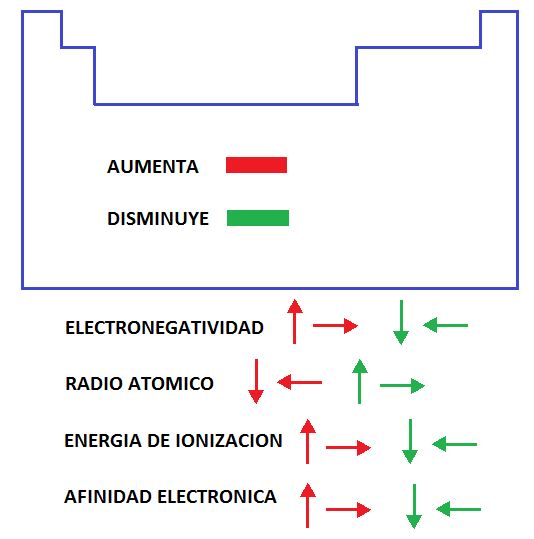
Electronegatividad: La electronegatividad es la tendencia que tiene un átomo de un cierto elemento a captar electrones. Si su electronegatividad es elevada significa que tiene mucha tendencia a atraer electrones de otro elemento que sería el dador. Los no metales son aceptores, es decir, electronegativos y los metales son electropositivos o sea, dadores de electrones. En la Tabla periódica la electronegatividad aumenta de izquierda a derecha dentro de un mismo período y de abajo hacia arriba dentro de un grupo. El elemento más electronegativo es el Flúor y el más electropositivo es el Francio.
Radio atómico: Básicamente es la distancia que hay entre el centro del núcleo hasta el electrón más externo. Si nos ubicamos dentro de un mismo grupo (vertical), como por ejemplo el grupo I (Alcalinos), le radio atómico será mayor obviamente para el Francio que se encuentra en el nivel o período 7 que el Litio que está en el 2. Al estar en el nivel 7 se encontrara a mayor distancia del núcleo por eso tendrá mayor radio atómico que el Litio. Ahora si estudiamos esta propiedad a nivel horizontal es algo más complicado de entender. Si estamos en un mismo nivel veremos que el número atómico crece hacia la derecha. Esto significa que un elemento ubicado más a la derecha tendrá mayor cantidad de electrones que su vecino de la izquierda. Al tener más electrones tendrá más protones (cargas positivas). Por lo tanto habrá más fuerza de atracción de los electrones hacia el núcleo y esto provocara una reducción aunque sea pequeña del radio atómico ya que la nube electrónica se acercara más al núcleo. En conclusión, los elementos ubicados más a la derecha dentro de un cierto nivel, tendrán menor radio atómico que los ubicados a la izquierda. Por eso, el radio atómico disminuye hacia la derecha.
Potencial de ionización: Es la energía que hay que entregar para arrancarle el electrón más externo a un átomo en su estado neutro y gaseoso. Cuando se trata del electrón más externo hablamos de la primera energía o potencial de ionización y si se trata por ejemplo del segundo será la segunda energía o potencial de ionización. Generalmente las bibliografías hablan más de la primera energía. Con respecto a un grupo esta energía aumenta de abajo hacia arriba. Se entiende porque si volvemos al ejemplo del grupo I será más complicado extraerle el electrón más externo al Litio o al Sodio que al Francio que está muy lejos del núcleo (nivel 7). Al estar tan lejos del núcleo hay muy poca atracción y por lo tanto es más fácil sacarle su electrón. Si ahora planteamos la misma situación a nivel de un periodo, o sea, horizontalmente, ocurre algo similar comparado con el radio atómico. Aumenta hacia la derecha porque hay mayor densidad electrónica en los elementos ubicados más a la derecha por tener mayor número atómico. Al estar con más electrones, habrán más protones y mayor atracción. Por este motivo se necesitara más energía o potencial para arrancarle algún electrón.
En los casos de iones también varían con respecto a sus átomos predecesores. Por ejemplo, el cloro al ganar un electrón queda negativo y su radio por consecuencia crecerá. Al contrario pasara con el sodio que al perder el electrón más externo se convertirá en un ion positivo con un radio obviamente menor al átomo de sodio neutro.
Afinidad Electrónica: Es similar a la electronegatividad. Es la energía liberada cuando un átomo en estado gaseoso capta un electrón. Aumenta y disminuye en los mismos sentidos de la electronegatividad.
Si tienes que realizar trabajos prácticos, necesitas resolver ejercicios para una prueba o examen, o quieres una clase particular, consulta precios al mail:
Otros artículos de interés:
Uniones Interatomicas e Intermoleculares
la quimica me gusta buena por la quimica
hay grassssss
robo de elctrone es bivalencia o trivalesncia
Gracias, no entiendo nada de química, pero sirvió muchísimo a la tarea de mi hijo-
Dios les bendiga!
Estamos para eso Walter cuando gustes te esperamos. Divulga el sitio abrazo
Gracias por la tarea me sirvió de muchísimo
De nada
gracias por su colaboracion
me parece piola y dale un like ami foto
ala firme me parece full piola k exista una pagina como esta me gusta mucho saber de ciencias xfa saken mas paginas sobre la ciencia…. GRACIAS
muy bien. porque ayuda mucho esa información para adquirir más conocimientos
buenas repuetas grasias
Muy buena esta página me sirvió de mucho para mi tarea gracias espero sigan publicando más
Gracias Margarita. Dale el me gusta para q nos tengas en tu face. Y difunde el sitio
no encontre el metal
es un poco muy buena
Que metal daniela?
gracias me ayudo mucho
me gustaría conocer las propiedades aperiodicas de los elementos, muy buena la informacion
Hola lee el post y lo entenderás.
no problem i ayudar in all
Muy Buena me sirvio bastante para mis trabajos. Gracias 🙂
Genial Pamela.
Hola, muy buena página. Tengo que exponer la clasificación de la tabla periódica por sus propiedades, cree que esta sea una información completa?
Si te ayudara.
La quimica es una materia excelete que nos ayuda a orientarnos y aprender mas de lo poco q sabemos
me ayudo mucho la informacion gracias
es buena carrera ser quimico? genomica para ser exactos
Toda carrera que te guste será buena para vos ya que la realizarás con toda tu pasión.
Buena información precisa y útil. ..Bendiciones
Gracias desde ya. Estamos para ayudarte
gracias muy buena información me sirvió
para una tarea del colejio
Genial Fernandaaa
gracias por la informacion.
ok
Para eso escribo Ruben, abrazo.
gracias por ayudarme con esta tarea de quimi me sirbio mucho
Genial Karol, lo mejor para vos
agradesco el esfuerzo de hacer esta pagina, esta excelente y gracias me sirvió en demacia bendiciones
GRACIAS agradezco su tiempo y me sirvió de muchísimo la consulta a esta pagina
reitero mi agradecimiento ……..bendicones
Gracias Carlos, bensiciones a vos también
gracias
Buenas tardes, soy estudiante de ingeniería bioquímica… Tengo una duda… en un taller me dan dos átomos enlazados, hay varias opciones, por ejemplo: C-C, C-H, C-O, H-N y H-F me pide señalar cuál tiene mayor momento dipolar, pero ¿de qué forma podría calcularla?
Busca alguna tabla de momentos dipolares.
gracias esto me va a ayudar a pasar la recuperancion !!!!!
Me alegro
Solo son esas¿
esta genial. muchísimas gracias por la información, me fue de mucha ayuda para mis tareas
Hola Clara, me alegro.
una pregunta PARA QUE SIRVE CONOCER LAS PROPIEDADES DE LOS ELEMENTOS QUÍMICOS.
Para muchas cosas, para saber mejor como se comportarán en las reacciones, para saber que propiedades físicas esperar, etc.
gracias capo, esta muy bueno el resumen, la vieja de trola química me toma parcial esta semana y gracias a vos no me van a romper el orto
me alegro Ivancitoooo.
una pregunta. la afinidad electrónica no es parte de las propiedades periódicas?
Si lo es Ivan.
mu mala la pagina no me sirvio de nada
🙁
necesito saber cuales son las propiedades fisicas y quimicas de los no metales
Si consideras que la página es mala para que haces preguntas?.