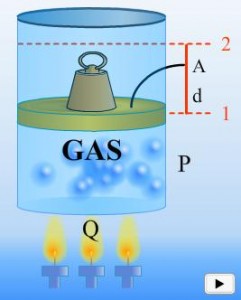
Antes de enunciar las principales leyes de la Termodinámica comenzaremos a definir algunos conceptos importantes. Llamamos sistema a la porción del universo cuya evolución se analiza en detalle y el medio representa al resto del universo. Cuando interaccionan ambos, el sistema puede recibir o ceder calor al medio. Otro participante en estos procesos es el trabajo. El trabajo puede aplicarse al sistema o el sistema puede realizar trabajo hacia el medio.
Antes de enunciar el primer principio de la termodinámica explicaremos algunas reglas a tener en cuenta como convención.
Si el sistema recibe calor del medio, el signo del calor es positivo. El calor será negativo en el caso que salga del sistema hacia el medio.
Si el sistema realiza trabajo contra el medio, el trabajo es positivo. Es cuando el sistema se expande. Si el medio realiza trabajo contra el sistema, entonces es negativo entonces el sistema se contrae.
Energía interna (ΔU): La energía interna en un sistema como podríamos imaginar el caso de un gas encerrado en un recipiente, está determinada como la sumatoria de varias energías a nivel molecular. Cuando el calor entra a un sistema como este, esperamos que el gas se expanda. Parte de esa energía que entra se ha invertido para el trabajo de expansión. Pero hay un sobrante que quedara en ese sistema para aumentar la energía de dicho sistema. Esta parte es la energía interna. Esta energía está representada por la energía cinética y vibracional molecular. Por lo tanto la energía interna es directamente proporcional a la temperatura, de hecho es una función de la temperatura.
Primer Principio de la Termodinámica:
Q = W + ΔU
Establece que el calor absorbido es igual al trabajo realizado más la variación de la energía interna en el sistema.
Acordemos que no es una suma como tal sino que depende de los signos establecidos en la convención explicada anteriormente.
Ahora explicaremos como se determina el trabajo en procesos diferentes.
Proceso Isobárico:
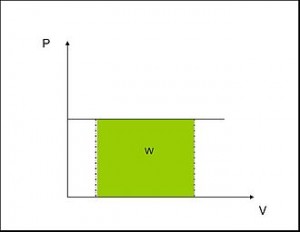
Proceso isobárico se entiende aquel en el cual la presión se mantiene constante. La expansión del gas produce un aumento de volumen. Por lo tanto el trabajo será:
W = P x ΔV
ΔV = Vf – Vi
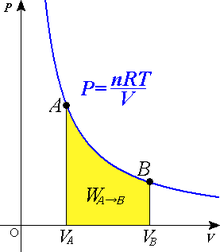
Proceso Isotérmico: Es el que se desarrolla con una temperatura constante. Aquí la formula es más complicada. El gas se expande a medida que ingresa el calor y su presión disminuye.
W = n x R x T x ln (V2 / V1)
Proceso Isocórico:
Esta transformación se da a un volumen constante. Por lo tanto al no haber variación en el volumen, no se produce ningún trabajo.
A continuación pondremos las fórmulas necesarias para la resolución de los problemas que s enos pueden presentar. Tengamos en cuenta que existen 4 procesos distintos en las transformaciones termodinámicas.
Proceso Isotérmico: Es el que se realiza a temperatura constante.
Proceso isobárico: Este se realiza a presión constante.
Proceso Isocórico: Se realiza a volumen constante.
Proceso adiabático: Se produce sin pérdidas ni ganancias de calor entre el sistema y el medio.
|
Isotérmico (T constante) |
Isobárico
(P constante) |
Isocórico (V constante) |
Adiabático (Sin pérdida de calor) |
| ΔU = 0 ΔH = 0 W = – Q W = -n.R.T. ln (Vf/Vi) | ΔU = Q + W ΔH = Qp Qp = n.Cp.ΔT W = -P.ΔV Qp = n.Cp.ΔT | W = 0 ΔU = Q Qv = n.Cv.ΔT
ΔH = ΔU + Δ(PV) =ΔU + n.R.ΔT |
Q = 0 ΔU = W
W= n.Cv.ΔT ΔH = ΔU + Δ (PV) |
Entalpía:
Esta es otra de las variables termodinámicas importantes. Como la energía interna, esta se caracteriza porque también es una función de estado. Es decir, sus valores se miden como diferencia entre estado inicial y final y no como valor absoluto. Por eso usamos también el símbolo ΔH y no H.
Básicamente la entalpía representa el cambio de calor de una reacción química a presión constante.
ΔH = ΔU + Δ (PV)
Al conocer el valor del ΔH podemos saber si una reacción libera o absorbe calor. Si su ΔH es positivo, es una reacción endotérmica o sea, absorbe calor para poder ser realizada. Pero si su ΔH es negativo, será una reacción exotérmica.
A continuación definiremos distintos tipos de entalpias.
Entalpia de reacción:
Es la diferencia de entalpia que se da en una reacción a una atmósfera de presión. Es la suma de las entalpias de los productos menos la suma de las entalpias de los reactivos.
aA + bB → cC + dD
ΔH°r = å H productos – å H reactivos
Entalpia estándar de formación:
Es la entalpia que acompaña a la formación de un mol de cualquier compuesto a partir de sus elementos a una presión de una atmósfera.
Entalpia de combustión:
Es la variación de entalpia que se observa cuando se hace reaccionar un mol de una sustancia en su estado tipo, con la cantidad de oxígeno necesaria para producir la combustión total de la misma, dando como único producto de reacción al CO2 y al H2O a una temperatura de 25°C y a una presión de 1 atmósfera.
Problemas ejemplo:
1) Calcula ΔU para un sistema cerrado que libera en forma de calor 60 KJ sabiendo que se realiza un trabajo sobre el igual a 100 KJ.
Aplicaremos la convención de signos explicadas. En este caso el calor será negativo ya que fue liberado y el trabajo positivo por ser realizado sobre él.
ΔU = Q + W
ΔU = -60 KJ + 100 KJ
ΔU = 40 KJ
Como observamos el signo de la variación de la energía interna resulto positivo por lo tanto indica un aumento en la energía interna del sistema.
2) Un mol de un gas ideal se encuentra a 1 atmósfera de presión y ocupa un volumen de 48 litros. Se realiza una transformación a volumen constante hasta alcanzar una presión de 1,50 atm y luego manteniendo la presión constante se comprime hasta un volumen de 17,7 litros. Calcula la variación de la energía interna.
Primero calcularemos las temperaturas correspondientes a la presión y volumen iniciales y finales para ordenar los datos.
Con la fórmula P.V = n.R.T calcularemos las temperaturas.
T = (P.V) / (n.R)
T = 1 atm. 48 l / 1 mol.0,082 atm.l.K-1.mol-1
T = 585 K
Para el estado final:
T = 1,50 atm.17,7 l / 1 mol.0,082 atm.l..K-1.mol-1
T = 324 K
| P (atm) | V (litros) | T (K) | |
| Iniciales | 1 | 48 | 585 |
| Finales | 1,50 | 17,7 | 324 |
Daremos los valores de Cv y de Cp son los capacidades caloríficas de los gases monoatómicos a volumen constante y a presión constante respectivamente. Es decir, la cantidad de calor necesaria para elevar a un mol de un gas en un grado de temperatura.
Cv = 12,5 J/mol° y Cp = 20,80 J/mol°
En la primera etapa tenemos la transformación a volumen constante:
Es una transformación isocórica, por lo tanto:
W = – P ext . ΔV W = 0
Calculamos el calor:
Qv = n.Cv.ΔV
Qv = n.Cv. (Ta – Ti) Ta = consideramos una temperatura intermedia entre la inicial y la final.
Ta = Pf . Vi / n.R = (1,50 atm . 48 lts) / 1 mol . 0,082 atm.l.K-1.mol-1
Ta = 878 K.
Ahora si calcularemos el calor a volumen constante.
Qv = 1 mol . 12,5 J/mol K . (878 – 585)K
Qv = 3662,5 J = 3,66 KJ
En la segunda etapa hay una compresión hasta un volumen de 17,7 litros. Se mantiene la presión constante.
W = -P ext. ΔV
W = -1,50 atm . ( 17,7 – 48) Litros
W = 45,4 atm . litro
Lo pasamos a la unidad de trabajo Joule (J):
45,4 atm.l x 8,314 J / 0,082 atm.litro = 4600 J = 4,6 KJ
Ahora calculamos el calor a presión constante (Qp):
Qp = n.Cp.ΔT
Qp = 1 mol . 20,80 J/molK . (324 – 878)K
Qp = -11523 J = -11,52 KJ
Ahora calcularemos e calor total de todo el proceso:
Q = 3,66 Kj – 11,52 KJ = -7,86 KJ
Este signo negativo indica que el sistema ha cedido calor al medio en todo el proceso.
Por otra parte calcularemos la variación de energía interna:
ΔU = Q + W = -7,86 KJ + 4,60 KJ = -3,26 KJ.
Al lector le puede interesar:
Excelente trabajo, gracias me ayudo para una exposición. saludos
Gracias te felicito