Existen varios parámetros termodinámicos para evaluar si una reacción química tendrá lugar espontáneamente o no. Hemos escuchado por ejemplo a la variación de entalpía (ΔH) que describe si las reacciones son endotérmicas o exotérmicas. Si son endotérmicas ΔH será mayor que cero y si son exotérmicas será menor que cero.
Otro parámetro es la variación de entropía (ΔS). La variación de entropía aumenta en los procesos espontáneos y disminuye en los procesos no espontáneos.
Sin embargo el parámetro mejor para decidir si los procesos químicos son o no espontáneos es la variación de energía libre de Gibbs (ΔH). Ya que esta mide el trabajo real y efectivo disponible para que una reacción efectúe una transformación bajo condiciones constantes de temperatura y presión. La diferencia de energía libre se calcula según la reacción:
ΔG = ΔH – T.ΔS
T es la temperatura absluta en grados K. La unidad será en Joules (J) o Kilojoules (Kj).
La variación de energía libre como cualquier parámetro termodinámico (ΔH o ΔS), se calcula como la diferencia entre la suma de los ΔG de los productos multiplicado a cada uno por el número de moles y la suma de los ΔG de los reactivos multiplicados también por el númeo de moles. Existen tablas que ponen los valores termodinámicos de cada sustancia. De esa manera el calculo es bastante fácil. Con los valores de ΔG se haría directamente. Si nos dan los valores de ΔH y ΔS lo hacemos aplicando la fórmula anteriormente expuesta para calcular el ΔG.
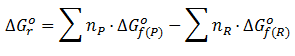
En otras ocasiones el ΔG se puede calcular a partir de la constante de equilibrio de la reacción. En la relación:
ΔG° = – R.T.(ln K)
El símbolo de ° hace referencia a las condiciones estándar que son a 1 atmósfera de presión y a 25° o 298 K de temperatura. Cuando las condiciones no son estándares el ΔG se calcula de la siguiente manera:
ΔG = ΔG° – R.T.(ln K)
Los valores posibles de ΔG y su significado en las reacciones químicas.
ΔG < 0 La reacción es espontánea
ΔG > 0 La reacción no es espontánea
ΔG = 0 La reacción esta en equilibrio.
Muchas Gracias por esto! 😀 Esta mucho mejor explicado que lo que dijo mi profe </3 Espero me vaya bien en el examen.
Excelente que te vaya bien Jean
Hola, soy una Estudiante de Medicina, Muchísimas gracias! excelente explicación..! mucho mas concreta con las demás variaciones! era exactamente lo que buscaba, para una buena exposición..
Gracias y que te vaya excelentemente.
Hola. . Me podrias explicar en q consiste como seria un ciclo energetico de vida. Porfabor gracias
Muchas gracias, me sirvió mucho esto<3
Hola! Muchas gracias por la explicación! Ha sido de Una pregunta, si tengo que calcular la ΔG en un proceso que no es isotérmico (por ejemplo, un calentamiento isobárico del agua) cómo lo hago? porque la fórmula ΔG = ΔH – T.ΔS está pensada para procesos isotérmicos
muchas gracias!!
La verdad no lo dé Gustavo.
Hola Patricio, con que aparato mido la energía libre de GIBBS…. agregando comentario, si es posible medir la entalpia con la energía media de enlace de un compuesto el cuál sería muy útil para cálculos termodinámicos, pero la ¿entropia?. Sabemos que existen tablas de compuestos conocidos, y que hay de aquellos que no? como mido esa energía libre de GIBBS.
Nunca vi un aparato que la mida
Buenas tardes profesor, en estoy un compañero me pregunto que pasaría si coloco a reaccionar el acido fosfórico + sulfato de bario, yo le respondí que no ocurría nada debido a que los acido reaccionan con bases o óxidos básicos. Sin embargo me quedo la duda si yo se lo puedo demostrar con el uso de la energía libre GIBBS, que esa reacción no es espontánea.
Hola Emilio. Podría ser. Usa la tabla de energías libres y comprobalo.
Hola, muchas gracias por la información. Estoy cursando la carrera de medicina. Una de mis preguntas para el parcial es: ¿Cuál es la definición de variación de energía libre en términos de la entropía del universo?
Ya se que si la variación de la energía libre es menor a 0 la reacción es espontánea y hay un aumento en la entropía, pero no entiendo cómo se definiría la energía libre en esta pregunta. Muchas gracias, espero tu respuesta
Creo que hay una fórmula que publique. Pero no la puedo escribir aquí. delta g = delta h – t.delta s.
Hola emilio, podrías explicarme qué es el tiempo de reacción media en química?
Alalguien puede hablarme del trabajo maximo en una pila??