La ecuación o formula de Henderson Hasselbach es muy útil para el cálculo del PH en las soluciones buffer o soluciones reguladoras. En estos sistemas hay dos especies bien definidas como el par ácido débil y su sal o Base débil y su sal correspondiente. Ya sabemos que en los ácidos fuertes o bases fuertes el cálculo de PH es muy sencillo. Solo basta aplicar esta formula PH = – log [H+]. Pero como dijimos, el cálculo de PH en los sistemas buffer es más complejo y aquí es donde radica la importancia de la ecuación de Henderson Hasselbach.
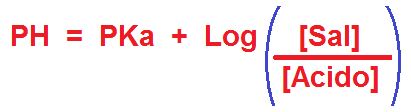
Aquí podemos observar que la ecuación tiene dos términos. El primero es el PK que se refiere al logaritmo negativo de la K. La K es la constante de disociación del ácido débil (Ka) o base débil (Kb) según corresponda. El segundo término se refiere al logaritmo de la relación de las concentraciones molares de la Sal con respecto a su Ácido débil. En el caso de una solución reguladora formada por el par base débil y la sal de esta base débil la ecuación toma esta forma.
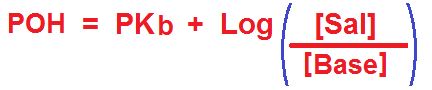
En lugar de PH se calcula directamente el POH. Luego se puede calcular el PH ya que como sabemos, PH + POH = 14. PKb en lugar de PKa. Después vemos que aparece la concentración molar de la base en lugar de la del ácido.
A continuación veremos un ejercicios para que entiendas como usar esta ecuación.
Calcular el pH de un buffer preparado disolviendo 45 g de acetato de sodio (Sal) en 500 ml de una
solución 0,2 M de ácido acético (ácido débil). Ka= 1,8 x 10-5 (1,8 x 10 a la menos 5).
Este es un caso del par acido débil/Sal de su ácido.
PH = PKa + Log ( [Sal]/[Acido]).
Como vemos, debemos calcular la Molaridad (M) de la sal. El acetato de sodio ( CH3COONa) tiene un PM = 82.
45 g x 1 mol / 82 g = 0.545 moles.
A su vez, estos moles están en un volumen de 500 ml (0,5 L). Por lo tanto su M es de 0545 mol / 0,5 L = 1,09 M. El log de ([Sal]/[Acido]) es de 0,736.
Por otra parte el PKa es – log (18×10 a la menos 5) = 4,745. Ya tenemos los dos términos de la ecuación de Henderson Hasselbach solo tenemos que sumarlos.
PH = 4,745 + 0,736 = 5.48
Espero te haya servido este artículo. Deja tus comentarios o dudas. Exitos.
Bioquímico y Profesor: Patricio Arroyo