Aquí como se explicó, el grupo carboxilo se halla unido a un anillo aromático o bien a una cadena carbonada que a su vez está unida a dicho anillo.
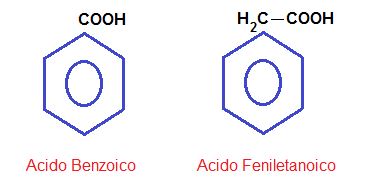
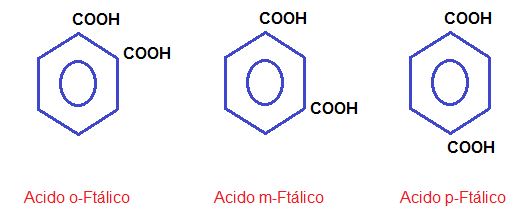
También encontramos dicarboxílicos o poli. Ejemplo: Ácido ftálico.
Estudiaremos algunas características del miembro más conocido (Ácido Benzoico):
También llamado ácido fenil metanoico.
Obtención:
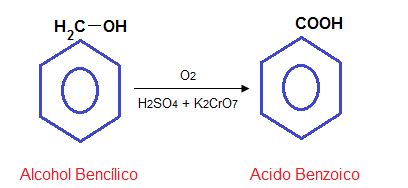
Se obtiene por oxidación del alcohol bencílico con la mezcla sulfocrómica (ácido sulfúrico y Dicromato de potasio).
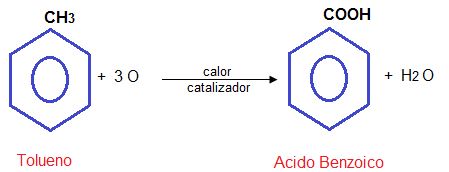
Industrialmente:
Oxidan al tolueno en presencia de calor y catalizadores potentes.
Propiedades Físicas: Es un sólido que cristaliza de color blanco. Funde a unos 121°C. Es insoluble en agua y soluble en solventes como éter y alcohol.
Propiedades Químicas:
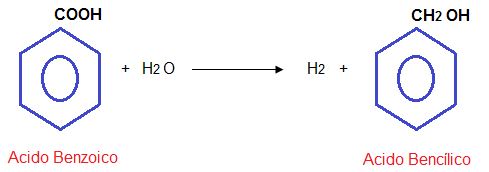
Hidrogenación:
Se hidrogena en medio ácido, dando alcohol bencílico.
Formación de sales:
El ácido benzoico reacciona con hidróxidos fuertes como los de los metales alcalinos y alcalinotérreos.
También puede formar ésteres con los alcoholes.
Hidroxiácidos:
Poseen en su estructura uno o más funciones ácidas y una o más funciones alcohol.
Ácido Láctico: se encuentra naturalmente en la leche ácida, en nuestro organismo después de un trabajo muscular suele acumularse y es el responsable de los calambres.
Propiedades físicas:
Una propiedad muy importante que tiene y que comparte con otras sustancias es la actividad óptica que posee, ya que es capaz de desviar la luz polarizada. Este fenómeno lo presentan aquellas sustancias que son ópticamente activas, no todas. Esta actividad óptica es otorgada por los carbonos asimétricos, como fue explicado en estereoisomería. Por lo tanto hay dos isómeros de esta ácido. El (+) y el (-) el + desvía la luz hacia la derecha y el – hacia la izquierda. Ambos son sólidos y funden a 26°C. Son inodoros. Son solubles en agua, alcohol y éter.
Propiedades Químicas:
Químicamente tienen las mismas propiedades que los otros ácidos y alcoholes. Pueden formar ésteres, éteres, amidas, sales. Sus sales se nombran como lactatos. Por ejemplo, lactato de sodio, lactato de calcio, etc.
Usos:
Se lo usa para acidificar bebidas acidas o caramelos o dulces. En medicina como astringente o antiséptico. En estética para depilación de pieles.
También los ácidos aromáticos presentan este fenómeno de tener en su molécula una o más funciones alcohol. Como ejemplo principal citaremos al ácido salicílico por su importancia.
Se lo encuentra como a casi todos los ácidos en forma de éster en algunos vegetales.
Obtención:
Por último el salicilato de sodio se combina con el ácido clorhídrico formando el ácido salicílico.
Propiedades Físicas:
Es sólido de color blanco cristalino. Algo soluble en agua.
Funde a unos 159°C.
Propiedades Químicas:
Por calentamiento fuerte da Fenol.
Produce sales al reaccionar con hidróxidos fuertes:
Reacciona con los alcoholes generando ésteres.
Usos:
Se emplea como conservante para algunos alimentos como jugos, bebidas, etc.
Sus sales para tratamiento de dolores musculares y reumatismo. El ácido acetil salicílico se utiliza como aspirina.
por favor necesito informacion del acido lactico para uso estético si me puede ayudar enviandome a mi correo
Hola Eulalia. No soy experto en el tema pero publico tu inquietud quizá alguien la responda.