La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes), gracias a la administración de corriente eléctrica.
Básicamente hay dos tipos de electrolitos, los llamados fuertes y débiles. Los utilizados en la electrolisis son los electrolitos fuertes. Esta familia está formada por todas las sales, ácidos fuertes e hidróxidos fuertes. Como bases fuertes podemos citar a las de los metales alcalinos y alcalinotérreos como los hidróxidos de Sodio, Potasio, Calcio y Magnesio. Como ejemplos de ácidos fuertes tenemos al ácido clorhídrico, sulfúrico, nítrico y perclórico.
Este proceso se tiene que llevar a cabo en un aparato llamado cuba o celda electrolítica. Está formada por dos electrodos de un metal inerte, por ejemplo Platino o Paladio. Conectados a una fuente de energía eléctrica o FEM. El circuito lo cierra justamente la sustancia que se va a disociar en iones, el electrolito. En algunos casos, cada electrodo se ubica en un vaso distinto por separado. Cuando esto sucede se usa un puente salino que los conecta. Es una especie de tubo en U con una sustancia iónica como una sal que permite el flujo constante de cargas.
La electrolisis tiene una utilidad muy grande en la industria. Ya que muchos procesos requieren de esta. Por ejemplo, cuando se quieren obtener elementos como Sodio, Aluminio, Litio y otros muchos metales. En la Galvanoplastia, cuando se quiere proteger a un metal de la corrosión, se le aplica una película de otro metal que es inoxidable. Para la producción de gases como el Hidrógeno y Oxígeno también se usa la electrolisis.
El científico que mejor estudio, explico y descubrió este proceso fue el Inglés Michael Faraday. Enuncio dos leyes importantísimas que se aplican en los problemas de electrolisis.
Primera Ley: La cantidad de sustancia depositada o liberada en un electrodo es directamente proporcional a la cantidad de electricidad (carga) que pasa por él.
Segunda Ley: La cantidad de electricidad que se requiere para depositar o liberar un equivalente químico de un elemento es siempre la misma y es aproximadamente 96500 C (Coulombs o Culombios).
Para recordar el concepto de equivalente químico, diremos que el equivalente químico de un elemento es igual al peso molecular dividido por su valencia. Si tiene más de una se usa la que utiliza en la reacción.
Las reacciones químicas de una electrolisis, son reacciones redox. Al electrodo negativo se llama Cátodo. Allí es donde ocurre la reducción y en el positivo o ánodo se produce la oxidación.
Veremos un caso de electrolisis. La del cloruro de sodio. Esta puede darse de dos maneras distintas. Cloruro de Sodio puro o fundido o Cloruro de Sodio en solución acuosa. En este último caso veremos que el agua toma fuerte participación en el proceso.
Cloruro de Sodio (NaCl) Fundido.
El NaCl se encuentra formado por sus dos iones Na+ y Cl–. El Na+ por ser positivo se dirigirá al electrodo negativo (Cátodo). Por este motivo se llamará Cátodo. Y su reacción será:
Na+ + e– → Na (Reducción).
En el otro electrodo (Ánodo), se producirá la siguiente reacción.
2 Cl– → Cl2 + 2e–
Multiplicamos a la primera reacción por 2 para equilibrar los electrones.
2 Na+ + 2e– → 2 Na
Sumamos las dos reacciones obteniendo la total.
2 Cl– + 2 Na+ → Cl2 + 2 Na
2 NaCl → Cl2 + 2 Na
Se obtiene cloro gaseoso en el Ánodo y Sodio en el cátodo.
Ahora veremos la electrolisis para el cloruro de sodio en medio acuoso.
Acá la diferencia se produce en el cátodo. El Sodio esta vez no participa del proceso de reducción sino que es el agua quien lo reemplaza. Esto tiene una explicación. Hay una propiedad que se llama Potencial de oxidación o Potencial de reducción. Actualmente se usa más el término potencial de reducción. Existen tablas en donde figuran la mayoría de los elementos y compuestos que se los ha llevado a electrolisis y los potenciales de reducción para cada uno de ellos. Esa capacidad está dada por valores numéricos. El potencial 0 corresponde al hidrógeno cuando pasa de catión a molécula neutra.
2 H+ → H2
A partir de este valor como parámetro se han medido muchísimos más para los demás elementos. El potencial de reducción del agua es superior al del sodio. Por eso cuando ambos se encuentran, el de mayor potencial será el protagonista en la reacción, en este caso de reducción. El Sodio tiene un valor de -2.714V y el agua de -0.828V. de manera que la reacción que tendrá lugar en el cátodo será:
2H2O + 2e– → H2 + 2OH–
Y en el ánodo será la misma que antes.
2 Cl– → Cl2 + 2e–
La reacción global es:
2H2O + 2 Cl– → H2 + 2OH– + Cl2
El sodio se mantuvo sin reaccionar, se conserva como Na+. Esta electrolisis es muy aprovechada en la industria ya que se produce Cloro gaseoso, Hidrógeno gaseoso, e Hidróxido de sodio por la combinación de los iones Na+ con los OH–.
Veremos otro caso. La electrolisis del Sulfato Cúprico (CuSO4).
Esta sal se disocia en los siguientes iones:
CuSO4 → Cu++ + SO4-2
El Cu++ se dirigirá al cátodo y se reducirá:
Cu++ + 2e– → Cu
La reacción anódica es algo más complicada. Los iones sulfato (SO4-2) que se suponen que se oxidaran en el ánodo, serán desalojados de este proceso por el agua. Esto se explica por el potencial de reducción más elevado que tiene el ion sulfato. El valor superior indica que el sulfato se reduce más que el agua o si invertimos los valores decimos que el agua tiene un mayor potencial de oxidación por lo tanto se oxida más que el ion sulfato.
2 SO4-2 → S2O8-2 + 2e– V= -2.07
4 OH– → O2 + 2 H2O + 4 e– V= -0.40
Como vemos, la reacción que se dará es la oxidación del agua y no la del ion sulfato.
Ejercicios:
Calcular cuántos gramos de Plata se depositaran en la electrolisis del AgNO3 si pasaron 4 amperes durante 30 minutos.
La reacción del catión Ag+ en este proceso será:
Ag+ + e– → Ag (reacción catódica).
Para saber la cantidad de masa depositada debemos calcular la cantidad de electricidad o culombios que circularon durante ese tiempo.
La cantidad de electricidad es igual a la intensidad de corriente multiplicada por la cantidad de tiempo.
Q = I.T
Las unidades que se usan para estas magnitudes son las siguientes:
Q = C (Coulombs)
I = A (Amperes)
T = S (Segundos).
Pasaremos el tiempo a minutos:
30 min x 60 seg / 1 min = 1800 seg
Cancelamos los minutos, quedando solo segundos.
T = 1800 segundos.
Ahora calculamos la cantidad de coulombs:
Q = 4 amp x 1800 seg.
Q = 7200 C.
Calculamos el equivalente químico de la Plata:
107 grs/1 = 107grs.
Si 96500 C depositan un equivalente químico de Plata. 7200 depositaran:
7200 C x 107 grs. / 96500 C = 7,98 grs.
Rta: 7.98 grs.
¿Cuántas horas se precisan para que se descomponga 1 gramo de agua en un proceso electrolítico con una corriente de un ampere?.
Tendremos que calcular la cantidad de coulombs requeridos.
4 OH– → O2 + 2 H2O + 4 e–
2.(2H20 + 2e– = H2 + 2OH–)__
2 H2O → O2 + 2 H2
1 gramo de H2O x (1 mol / 18 grs) x (4 mol e / 2 moles) x (96500 C / 1mol e) = 10722,22 C
Como tenemos la intensidad de corriente, calculamos el tiempo requerido para este proceso.
T = Q/I
T = 10722.22C/3
T= 3575 seg.
3575 seg x 1 hora / 3600 seg = 1 hora
Calcular el peso de cobre que se producirá por la reducción de iones Cu++ luego del paso de 3.2 amperes de corriente durante 40 minutos, por una solución de Sulfato de Cobre. ¿Qué volumen de oxigeno en C.N.P.T. se generara por la oxidación del agua?.
Al igual que en el problema anterior pasamos a segundos el tiempo.
40 min x 60 seg / 1 min = 2400 seg
Q = I.t
Q = 2400 seg. X 3.2 amp.
Q = 7680 C.
Calculamos el equivalente químico del cobre, en este caso:
63.54 grs/2 = 31.77 grs.
7680 C x 31,77 grs / 96500 C = 2,53 grs
Para calcular el volumen de oxigeno generado debemos usar la oxidación del agua:
4 OH– → O2 + 2 H2O + 4 e–
Observamos que por cada mol de oxigeno producido se usan 4 moles de electrones. Y cada mol de electrones está asociado a 96500 c de carga.
7680 C x ( 1mol e / 96500 C ) x ( 1 mol O2 / 4 mol e ) x ( 22,4 lts / 1 mol O2 ) = 0,445 lts
PILAS:
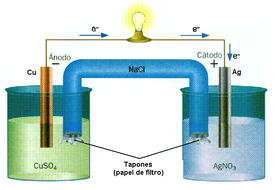
Son aquellos instrumentos que producen energía eléctrica mediante reacciones redox espontaneas.
Al igual que la cuba electrolítica, las pilas están compuestas por dos electrodos, cátodo y ánodo, conectados a dos terminales. En el cátodo se produce la reducción y en el ánodo la oxidación.
La diferencia es que aquí, el cátodo es positivo y el ánodo negativo. Aparte el sentido del proceso es inverso, ya que no se aplica energía eléctrica para producir iones sino que la reacción redox es la que provee energía eléctrica. Esta energía se cuantifica a través de la diferencia de potencial generada por la pila, la cual se mide en Volt (V).
Generalmente los electrodos están formados por metales o no metales en contacto directo con sus iones. Todos los valores de potenciales de reducción de los elementos e iones se encuentran tabulados en condiciones estándar. Se denomina tabla de potenciales estándar de reducción. Las condiciones estándar se refieren a una temperatura de 25°C y una concentración molar de los iones de 1M, para los gases una presión de 1 atmosfera. Los valores han sido calculados gracias a los electrodos de referencia, es decir, para saber el potencial de reducción del cobre por ejemplo, se forma la pila entre este y un electrodo de referencia cuyo valor se establece. El más usado ha sido el electrodo normal de hidrógeno, asignándosele el valor 0. Por lo tanto si el valor de la pila entre este y el cobre da 0.336v, deducimos que el valor del potencial de reducción del Cu+2 a Cu es de 0.336v. Mientras mayor es este potencial significa que el elemento tiene más tendencia a reducirse que otro. Esto sirve para saber quien se oxidara y reducirá cuando enfrentamos dos elementos en una pila. El de mayor potencial se reducirá y de menor potencial se oxidara.
Ejercicios:
Determinar entre los cationes Ag+ y Cu++, quien se oxida y quien se reduce en condiciones estándar si los enfrentamos en un proceso electrolítico.
Primero hay que consultar la tabla de potenciales estándar de reducción.
Ag+ + e– → Ag 0.779v
Cu2+ + 2e– → Cu 0.336v
Con estos valores vemos que la plata tiene un mayor potencial de reducción, o sea que se reducirá más que el cobre. Por este motivo, la plata se reducirá y el cobre se oxidara.
2 Ag+ + 2 e– → 2 Ag Cátodo
Cu → Cu2+ + 2e– Ánodo
2 Ag+ + 2 e– + Cu → 2 Ag + Cu2+ + 2e–
Si calculáramos el potencial estándar de la celda, veremos que arroja un valor positivo. Esto significa que el proceso descripto con las reacciones es espontaneo, por lo tanto, el correcto.
El potencial de una celda se calcula restando al potencial catódico el potencial anódico.
E° = Ec – Ea
E° = 0.779v – 0.336v
E° = 0.443v
Si se tienen dos electrodos que se quieren acoplar:
Cd+2, Cd = -0.403v
Sn+2, Sn = -0.136v
a) ¿En qué electrodo ocurrirá la oxidación?
b) ¿Cuál de los potenciales de reducción es el más negativo?
c) ¿Cuál será el polo positivo de la pila?
La oxidación ocurrirá en el electrodo con menor potencial de reducción, o sea, en el de Cadmio.
El potencial de reducción más negativo es el de cadmio.
El polo positivo de la pila esta en el cátodo, o sea, en este caso en el de estaño.
Los valores de potenciales de reducción para el Zn y Cu son:
Zn+2/Zn = -0.763v Cu+2/Cu = 0.336v
a) Calcular la FEM de la pila
b) Escribir las reacciones que ocurren
c) Haga un esquema de la pila.
La FEM o diferencia de potencial de la pila se calcula con la fórmula
E° = Ec – Ea
E° = 0.336v – ( – 0.763v)
E° = 1.1 v
Las reacciones del proceso son:
Cu+2 + 2e– → Cu Cátodo (Reducción)
Zn → Zn+2 + 2e– Ánodo (Oxidación)
La notación simbólica de esta pila es:
Zn/ZnSO4(1M)//CuSO4 (1M)/Cu
La parte de la izquierda representa al ánodo y su reacción. Formada por el Zn y su ion. Constituye el polo negativo. A la derecha se encuentra el cátodo de cobre con sus iones Cu++. Ambas semipilas están unidas por el puente salino simbolizado por la doble línea.
En muchos casos, las concentraciones se alejan del estado estándar de 1M. Para estas nuevas condiciones, existe una ecuación que se ajusta bien para el cálculo de los potenciales de las pilas.
La ecuación de Nernst se utiliza con este propósito.
E = E° – (0,059 / n) x log Q
E = Potencial en condiciones no estándar.
E°= Potencial estándar
Q = Cociente de reacción
n = Número de moles de electrones
El valor 0.059 es una constante que involucra a la Temperatura absoluta, la R (Constante d los gases, 8.314J/mol K) y el valor del Faraday (96500 J/Vmole-).
Cuando hablamos de Q, estamos haciendo referencia al cociente de reacción. Es igual a cociente entre las concentraciones molares de las especies reducidas elevadas a sus coeficientes estequiométricos dividida las concentraciones molares de las especies oxidadas elevadas también a sus coeficientes estequiométricos.
Q = [ Red ]y/ [ Ox ]x
Ejemplo:
Calcular la FEM de la siguiente pila teniendo en cuenta las concentraciones de los siguientes iones:
[Cr2O7-2] = 0,5M, [Cr+3] = 0.2M, [Fe+3] = 0.6M, [Fe+2] = 0.3M [H+] = 0.4M
Primero debemos determinar quien se oxidaría y quien se reduciría consultando las tablas de potenciales redox.
Fe+3/Fe+2 = 0.770V
Cr2O7-2/Cr+3 = 1.333V
Vemos que según los potenciales de reducción estándar el cromo tiene más tendencia a la reducción, ya que pasa de Cr +6 a Cr +3. Si las concentraciones fuesen las estándar no habría ninguna duda de la dirección de estas reacciones redox. Pero aquí cobrara importancia las concentraciones de las especies en la FEM de la pila.
Cr2O7-2 + 14 H+ + 6e– → 2Cr3+ + 7H2O
6x(Fe+2 → Fe+3 + e–)______________
Cr2O7-2 + 14 H+ + 6e– + 6Fe+2 → 2Cr3+ + 7H2O + 6Fe+3 + 6e–
E° = 1.333v – 0.770v
E° = 0.563v.
E = 0.563v – 0.059 x log [Cr+3]2. [Fe+3]6 / [Cr2O7-2].[H+]14.[Fe+2]6
E = 0.563v – 0.059 x log [0.2M]2. [0.6M]6 / [0.5M] . [0.4M]14.[0.3M]6
E = 0.563v – 0.059 x 6.284
E = 0.563v – 0.37v
E = 0.193v.
Excelente esta pagina de quimica
buena pagina!! 🙂
Hola. increible aporte. Muchas gracias..!!
No tendras informacion sobre todos los componentes de una pila de combustible y su ensamblaje? Estoy fabricando un dispositivo casero de electrolisis para almacenar hidrogeno y oxigeno por separado. Solo necesito algunos datos (a poder ser graficos) para emplear tecnologia inversa y poder desarroyar un dispositivo casero.
Gracias.
bien tengo una duda… con el objetivo de calentar 40 litros de agua en un recipiente de plástico, con los siguientes materiales: 2 barras pequeñas de aluminio, 40 litros de agua, cable eléctrico forrado de plástico y relleno de cobre platinado.
la duda es… el agua después de 6 horas llega a calentarse, el consumo eléctrico es mínimo comparado con hacerlo con los calentadores de resistencia vendidos, ¿el agua se puede utilizar para el aseo personal? el agua se nota limpia excepto por el residuo del aluminio que deja al hacer reacción con el agua ya que el material simula la electrolisis pues sus terminales nunca se tocan.
Hola no veo el problema el agua no esta contaminada. Ahora no veo práctico que uses ese agua para aseo pero si la queres utilizar no veo el problema.
Hola, supongo que habrá oido hablar de la plata coloidal por electrolisis, he comprado un generador con salida 34 volvios, y pinzas cocodrilo, en teoría la plata coloidal se hace con plata 999 de pureza y agua destilada, a mi me sale transparente aunque con un poco de sabor amargo a 15 ppm, aunque dicen que no debe saber a nada, me preocupa el color negro que se le queda a uno de los electros de plata, el otro tambien se oscurece pero menos, ¿qué es lo que queda en el agua, micro partículas de plata o tambien oxido de plata? no me fio de lo que dicen por internet ya que no explican qué es las sustancia negra que se adhiere al electrodo y si ésta pása tambien al agua y en tal caso supongo que resultaría tóxico ingerirlo. Muchas gracias de antemano!
Por lo que me dcis debe ser un tipo de óxido que se genera
yo quiero hacer plata coloidal como lo dicen en internet tengo todos los elementos el agua bidestilada la fuente de poder la plata los pongo a trabajar y no se produce la electrolisis que me falta ise una prueba pose sal a la agua y si se produjo la electrolisis pero en las instrucciones originales no dice que se le ponga nada al agua como me pueden alludar
disculpen en el problema
Calcular cuántos gramos de Plata se depositaran en la electrolisis del AgNO3 si pasaron 4 amperes durante 30 minutos.
I=4A
T=30mim
q=4A x 30mim x 60 seg = 7200
entonces tenemos gracias a la ley de faraday que
masa depositada= equiv-g-/96500 x 7200
el equiv-g= Ma/valencia
equiv-g=107/1=107
entonces
masa depositada=107/96500 x 7200 =7,983g
Asi es Gabriel ya lo correjimos. Habiamos puesto como verás 1800 seg pero después pusimos 180 y por eso se arrastro el error. Gracias.
En elbultimo problema.. no entiendo xq el q tiene mayor potencial de reduccion es el Fe, si este tiene un pot de 0.770v y el Cr tiene 1.333v.. xq no seria el Cr el de mayor potencial??
Gracias por la observación. Escribi que el hierro tenía más tendencia a reducorse y es la revés. Tiene en todo caso mayor tendencia a oxidarse. Pero si vos te fijas las reaccciones estan bien escritas ya que puse que el Fe se oxida y el cromo se reduce. Gracias ya esta corregido.
!!!!!U R G E N T E !!!!!!! Hola Quisiera conocer el procedimiento completo para la obtencion de hipoclorito de sodio por medio de electrolisis, he estado experimetando pero he obtenido soda caustica y cloro legia pero no he obtenido el hipoclorito no se si sea muy poco gas cloro que he obtenido por que la densidad es la adecuada pero el ph no, tengo duda si los metales que estoy ocupando no sean correctos ya que estoy utilizando carbon que era de una bateria y plomo, o el procedimiento que estoy realizando es incorrecto, agradeceria mucho si me apoyan con este proyeto por que ya lo he realizado en diferentes formas y ya no se que es lo que estoy haciendo si me lo pueden explicar paso a paso y que se obtiene en cada que por que al igual que lo he realizado en varias forms diferentes he obtenido diferentes resultados que ignoro que son gracias.
No creo q sea buena idea obtenerlo por electrolisis. Proba con otro metodo
muy bueno me ayudo y disipo algunas dudas
Quisiera saber si alguien me puede esplicar cuales son los materiales que forman los electrodos y que tipo de corriente utiliza desde ya muchas gracias
Hay de varios tipos de platino por ejemplo. Lo que si deben ser inertes para reaccionar o sea no formar parte de la reacción. Ahora si es pila si podría tener un metal en comun con el soluto o sal disuelta. Por ejemplo la famosa pila de Daniel. Cobre sulfato de cobre y zinc sulfato de cinc.
una pregunta, quiero sacar la plata que contiene la película de negativos de imprenta , ¿es posible sacarla por medio de electrólisis? gracias
Hola. Yo creo q si. Usando un catodo que por carga negativa atraera a los iones plata. Igual deberias consultar con alguien q se dedique a ese tema.
hola!! no sé si estoy en lo correcto pero creo que en el último ejercicio de la reducción de dicromato a crómico al aplicar nernst, falta dividir el 0,059 por 6. Muy buena la página, está bueno compartir los conocimientos. saludos!!
Gracias David lo examinare.
Muy bueno y muy bien explicado, estuve buscando en diferentes sitios y aqui si entendi todo por ser mas claro, tengo unas dudas, ojala me pudieran ayudar,
Tengo Au disuelto en cianuro de sodio, si lo quisiera metalizar por electrolisis de que metales deberia ser el catodo y el anodo?
Que pasaria si tiene 10 o 20 amp?
Muchas Gracias
Gracias Raul sinceramente deberias buscar en un sitio especializado en pilas aqui solo ponemos información general.
hola me gustaria saber como se aplica la electrolisis a los recubrimientos electrolíticos y si tienen un esquema del proceso seria lo mejor
No somos especialistas en electrolisis Bárbara. Solo expusimos los fundamentos teoricos.
exelente informacion, con esto aprendi algo nuevo.. gracias!!.
una duda con este ejercicio! la cantidad de corriente segun en la pregunta es de 1 Ampere, pero al aplicarla formula veo que tiene puesto 3, porque? es un error?. gracias espero solucionar esa duda.
¿Cuántas horas se precisan para que se descomponga 1 gramo de agua en un proceso electrolítico con una corriente de un ampere?.
Como tenemos la intensidad de corriente, calculamos el tiempo requerido para este proceso.
T = Q/I
T = 10722.22C/3
T= 3575 seg.
3575 seg x 1 hora / 3600 seg = 1 hora
Hablas de un ejercicio del post?.
¿por que se dice que es quimica?
A que punto te referís ian?
¿Qué relación debe existir entre el cátodo y la sustancia electrolítica? y entre el ¿Ánodo y su sustancia electrolítica? y ¿Porqué? 🙂 Gracias
Podrías explayarte mas male?
¿Cuántos gramos de cloro se obtendrán por electrolisis del cloruro de sodio fundido, cuando se pasa una corriente de 30 ampere durante 10 minutos?
¿Cuantos gramos de sodio se depositaran en este proceso?
Consulta bien en el post alli explico la formula a usar. Solo cambian los valores. Primero plantea las ecuaciones de oxidación y reducción. Asi sabrás cuantos electrones hay en juego. En el caso del cloro habrán 2 electrones por molécula de cloro formada. Pasa los minutos a segundos siempre antes.
carga = 30 a x 600 seg = 18000 coulombs.
18.000 c x 1 mol de e- / 96500 c x 71 grs / 2 moles de e-
Hola buen dia,
porque decis que en el caso del Cl habran 2 electrones por molecula de cloro formada
gracias
Porque son dos átomos y por átomo desprenderá solo un electrón. Entonces para formar la molécula biatómica (Cl2) desprenderá dos electrones.
Hola!!
como puedo hacer para construir una pila en condiciones no normales que me de 6 voltios .
No lo sabemos Karen, si encuentro la forma te digo.
libros recomendados sobre este tema amigos? me piden en un trabajo que agregue bibliografia
sabes que el articulo sobre la electrolisis me parece muy bueno pero si me gustaria que hubiesen por lo menos unos dos ejercicios mas para el calculo de de la masa del electrolito o de cada ión gracias y nuevamente felicitaciones es de gran ayuda
Muy buena tu página!!! 😀
Disculpa como se resuelve un problema en el que se calcula el potencial de reducción pero no en condiciones estándar, así como 0.2M a 29 ºC
Gracias!!
Tenes que usar la ecuación de Nernst que allí la explico con ejemplos
Hola en la pila cuso4 + agno3 ella genera electricidad como la de daniells
hola buena tarde una duda tengo un baño de 35lts de cobre alcalino pero pero quiero saber cuantos kilos de material de fierro puedo meterle o como lo calculo si mi voltaje es de 5
Y que queres hacer?.
Hola Patricio,
Tienes un correo dónde escribirte.
Gracias
Celso P
[email protected]
Hola buenas necesito que me ayude a entender algo de la electrolisis. Basándome en el ejemplo del NaCl en disolución acuosa no logro entender por qué reacciona el Cl- con el agua y no podría haber ocurrido la reacción de reducción del sodio y oxidación del agua.
Eso depende de los potenciales de oxidoreducción de los componentes. El sodio no participa porque su potencial de reducción es menor que el del agua. Fijate y busca en las tablas de potenciales de reducción
Hola, esta muy bueno! pero lo unico que no entendi es como calculaste el volumen de los productos obtenidos en electrolisis, hay alguna formula general?
Saludos!
Hola, mi pregunta es la siguiente:
Cómo puedo relacionar la ecuación o ley de Nernst para una batería secundaria de litio-ion, en caso que no sea aplicable ¿Por qué no? ¿Que variables o factores debo considerar? ya que la ecuación de Nernst nos permite hallar el voltaje o potencial de una celda en el proceso de ox-red y una batería en el proceso de carga y descarga lo realiza a un voltaje de operación.
Es una pregunta demasiado específica.
Hola,tengo una gran duda para una celda electroquimica y utilize el aluminio y cobre y sosa caustica con agua como seria la reaccion o como seria el calculo de log Q?
Hola, existe algún compuesto químico o papel tornasolado que me permita determinar si el electrolito (ácido sulfúrico diluido en agua destilada : densidad 1,3 g/cm3) de las baterías de plomo ácido no esta contaminado con sales EDTA u otro compuesto. Muchas Gracias
muy bueno disculpe. Una explicacion clara de la refinacion que el cobre se somete a electrolisis
Buen día tengo Una celda de concentración de oxígeno, está formada por dos electrodos de Zn. Uno de ellos está
sumergido en agua con baja concentración en oxígeno, el otro, en agua muy aireada, con mayor
contenido en oxígeno. Los dos electrodos se conectan con un cable de cobre.
a. ¿Cuál de los dos electrodos experimentará corrosión?
b. Formular las semi-reacciones
No conozco este tipo de combinaciones. La publicaré igual a ver si alguien te ayuda.
Que otro material podría emplearse en reemplaza la barra de grafito
Cómo podría citar esta pagina en APA
Que es APA?
hola mi nombre es jorge soy medico veterinario y agricultor en michoacan mexico y
estoy buscando como hacer una celda electrolítica para hacer dióxido de cloro a partir de clorito de sodio. podrías ayudarme por favor.
gracias
Hola Jorge, no. No soy experto en Celdas. Solo expuse los principios.