Hola queridos amigos. En este artículo les voy a enseñar a formar y balancear sales. Sin embargo debo aclarar que para poder armar sales deben tener en claro y conocer bien a los hidróxidos y ácidos ya que con estos formamos a las sales. A continuación veremos algunos ejemplos que les van a clarificar muchísimo este tema.
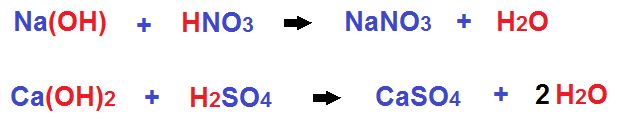
Ácido Nítrico + Hidróxido de Calcio
En fórmula es:
HNO3 + Ca(OH)2
En el caso de las sales, siempre se forma agua como subproducto. El H2O como sabemos está formada por el catión hidrógeno (H+) y el anión oxhidrilo (OH-). Estos provienen del ácido y del hidróxido respectivamente como vemos en la siguiente imagen.
![]()
Por otro lado, el catión metálico, en este ejemplo el Calcio (Ca ++) se unirá al anión del ácido (NO3-). Al ser cargas opuestas se unirán.
Después solo tenemos que balancear a estos H+ y OH-. Para la formación de agua estos iones están en la relación 1 a 1. Como el hidróxido presenta 2 OH- necesitaremos también 2 H+ del ácido. Por lo tanto si balanceamos a la izquierda estas cantidades ya tendremos balanceada cualquier sal que queramos formar. En este caso particular tendremos 2 H+ y 2 OH- para formar 2 moléculas de agua. De esta manera queda balanceada la sal. Nitrato de Calcio (Ca(NO3)2).

Con respecto a la nomenclatura no seré muy amplio porque no es la finalidad de este artículo. Pero para recordar la Nomenclatura tradicional, de las terminaciones de los nombres de los ácidos dependen las terminaciones en los nombres de las sales. Si los ácidos terminan en «oso» las sales terminan en «ito» y si los ácidos terminan en «ico» las sales en «ato». En este caso que vimos el ácido nítrico formo el nitrato de sodio.
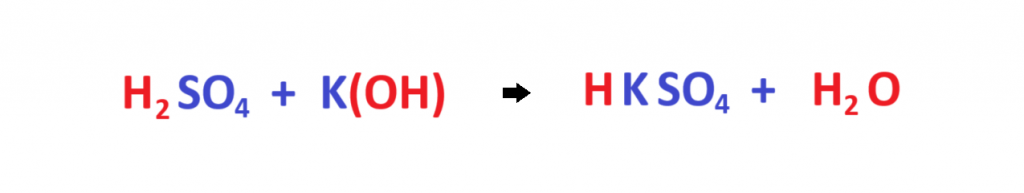
Con respecto a la formación y balanceo. En otros casos más sencillos veremos que no es necesario balancear ya que de entrada están balanceadas las cantidades de H+ y OH+. En estos ejemplos vemos la formación de Nitrato de Sodio y Sulfato de Calcio respectivamente.
En estos casos vimos ejemplos de sales neutras. En estas, lo H+ quedan totalmente neutralizados con una misma cantidad de OH-. Ahora veremos el caso de una sal ácida. Recordemos que son aquellas sales en las que en el proceso de formación de la sal quedan uno o más hidrógenos sin neutralizar. Este es el ejemplo del Sulfato ácido de Potasio. Como observan, Un H que no ha sido neutralizado queda en la molécula de la sal.