La Calorimetría es la parte de la física que se encarga de medir la cantidad de calor generada o perdida en ciertos procesos físicos o químicos.
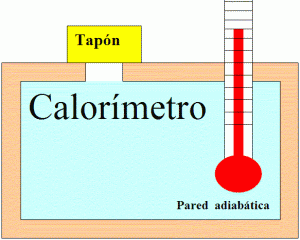
El aparato que se encarga de medir esas cantidades es el calorímetro. Consta de un termómetro que esta en contacto con el medio que esta midiendo. En el cual se encuentran las sustancias que dan y reciben calor. Las paredes deben estar lo más aisladas posible ya que hay que evitar al máximo el intercambio de calor con el exterior. De lo contrario las mediciones serían totalmente erróneas.
También hay una varilla como agitador para mezclar bien antes de comenzar a medir. Básicamente hay dos tipos de calorímetros. Los que trabajan a volúmen constante y los que lo hacen a presión constante.
La cantidad de calor que recibe o transmite un cuerpo esta determinada por la siguiente fórmula:
Q = m x Ce x (Tf – Ti)
Donde Q es el calor, m es la masa del cuerpo, Ce es el calor específico del cuerpo, que esta determinada por el material que lo compone. Y la variación de temperatura se representa por la diferencia entre Tf y Ti (temperatura final e inicial).
Cuando un cuerpo transmite el calor hay otro que lo recibe. Este es el principio del calorímetro. El termómetro es el que determinara la temperatura final del proceso también llamada temperatura de equilibrio. El líquido más usado es el agua, que actúa como receptor de las calorías que transmite el cuerpo. El calor específico del agua es de 1 cal /grs °C. Cuando el agua hierve o se congela, este valor cambia. Pero por ahora daremos ejemplos mientras este como agua líquida. Las unidades pueden variar. A veces podemos ver otras unidades como J/grs°C donde J es el joule en lugar de la caloría. Ambas son unidades en las que se mide el calor.
Por ejemplo, si introducimos un trozo de cobre de 60 gramos a 100°C en 260 ml de agua a 18°C, y tenemos que determinar la temperatura final del equilibrio, podemos calcularla de la siguiente manera:
El calor que cede el cobre será igual al calor que recibe el agua. Por lo tanto:
– Q Cu = + Q H2O
El signo menos se le coloca al que desprende calor y el signo más al que absorve.
– masa Cu x Cecu x (Tf – 100°C) = masa H2O x CeH2O x (Tf – 18°C)
– 60 grs x (0,093 cal/°c.gr) x (Tf – 100°C) = 260 grs x (1 cal/°c.gr) x (Tf – 18°C)
Solo queda despejar la Tf.
-5.58 cal/°C x (Tf – 100°C) = 260 cal/°C x (Tf – 18°C)
Aplicamos la propiedad distributiva:
-5.58 cal/°C Tf + 558 cal = 260 cal/°C Tf – 4680 cal
558 cal + 4680 cal = 260 cal/°C Tf + 5.58 cal/°C Tf
5238 cal = 265.58 cal/°C Tf
5238 cal / 265.18 cal/°C = Tf
19.72°C = Tf
En otros problemas a veces nos piden averiguar el calor específico de un cierto material. Por ejemplo:
Se introducen 20 gramos de aluminio a 90°C dentro de un calorímetro donde hay 106 grs de agua a 38°C. La temperatura final del equilibrio es de 40°C. Se desea saber el calor específico del aluminio.
El calor entragado por el cuerpo mas caliente (Aluminio) es igual al calor recibido por el mas frio (agua).
– Q aluminio = + Q agua
– masa Al x CeAl x (Tf – Ti) = masa agua x Ce agua x (Tf – Ti)
– 20 grs x CeAl x (40°C – 90°C) = 106 grs x 1 cal/grs°C x (40°C – 38°C)
– 20 grs x (-50°C) x CeAl = 106 cal/ °C x (2°C)
1000 grs °C x CeAl = 212 cal
Ce Al = 212 cal / 1000 grs °C
CeAl = 0,212 cal/grs°C
En otros, el calorímetro participa. Por ejemplo:
Se introducen 30 grs de Aluminio a 120°C en un calorímetro de cobre de 360 grs donde hay 200 grs de agua a 20°C. Calcular la temperatura final del equilibrio.
El calor que pierde el aluminio es igual al que gana el calorímetro y el agua.
– QAl = + Q agua + Q calorímetro
– 30 grs x 0,212 cal/gr°C x (Tf – 120°C) = 200grs x 1 cal/gr°C x (Tf – 20°C) + 360 grs x 0,093 cal/gr°C x (Tf – 20°C)
6,36 cal/°C Tf + 763,2 cal = 200 cal/°C Tf – 4000 cal + 33,48 cal/°C Tf – 669,6 cal
6,36 cal/°C Tf – 200 cal/°C Tf – 33,48 cal/°C Tf = – 4000 cal – 669,6 cal – 763,2 cal
-227,12 cal/°C Tf = – 5432,8 cal
Tf = – 5432,8 cal / – 227,12 cal/°C
Tf = + 23,92 °C
Te dejo este video para aclarar más y ampliar el tema Calorimetría.
Si necesitas ayuda para resolver trabajos prácticos o prepararte para las evaluaciones consulta por nuestro servicio de clases online y con gusto te haremos un presupuesto. Escribe al mail:
Gracias por su explicación, muy clara y sin tanto rodeo. Quisiera saber si además de esta página, también tienen algún video. Gracias nuevamente.
Hola, mira lo que estamos por lanzar dentro de poco tiempo es un ebook del sitio con toda la información ordenada tanto teorico como practico con ejercicios resueltos si te interesa avisanos
Nos sirven muchísimo sus explicaciones.
Tendría videos que expliquen termodinámica y equilibrios entre fases?
Aún no Solange pero pronto haré mas videos.
Estaremos esperando el ebook del sitio para poder estudiar los temas de nuestro interés. Son buenas explicaciones tanto prácticas como teóricas.
El ebook ya esta listo y contiene todos los temas de química.
Hola, a mí me interesaría mucho. Me gusta mucho su página. Los contenidos se muestran muy claros y fáciles de entender. Yo estoy en una escuela secundaria técnica, en mi caso industrial con especificación química y electromecánica, yo me encuentro en la rama de química, en 5to año. Y la verdad es que me ayuda mucho toda la información que sube.
Gracias Sofi, lo que necesites a tu disposición. Podes seguirme en face igual.
Tipos de energía calorica?
Es esa. La calórica.
Su artículo sobre calorimetría me ha servido de mucho para poder enseñarlo a mis educandas, le agradezco por la información tan importante y concisa en él.
Me gustaría muchos recibir sus artículos, ya que soy una amante y apasionada de la química y me gustaría saber más de ella, soy educadora de esa rama y de biología.
Gracias por su atención
Gracias Sandra.
Hola…gracias por la explicación
Pero tengo una pequeña duda:
¿Por qué el calor recibido es igual al calor dado?
Gracias de nuevo y espero respuesta,
Saludos:)
cometiste el error de anotar en la cuenta los 260 ml de agua como gramos. Lo que no es lo mismo (una es una medicion de volumen, la otra de peso). La cuenta ya da un equivocado resultado.
Hola Joel. En realidad es perfecto ya que el agua es la única sustancia que tiene de densidad iual a 1 o sea 1 gramo/mililitro o sea que 260 ml son 260 grs entendes?. Por lo tanto es correcto sin lugar a dudas que el valor que puse equivale en peso y volumen. Espero te haya quedado claro y hayas aprendido este nuevo concepto que por lo visto no lo sabías.
Una observacion a ambos ,cometen un error al cofundír peso con masa. Tengan mas cuidado
Donde se confundio Raúl?
quisiera saber cuales fueron los fisicos que estudiaron la calorimetria aunque sea 3
El mas importante sin dudas fue James Prescott Joule, investigo aparte el equivalente entre calor y trabajo.
hola ,, quisiera saber por que en el primer ejemplo del cobre , cuando Cecu es igual a (0,093 cal/°c.gr)?? . no entendi esta parte resien hora estoy viendo el tema
gracias.
es el calor específico del cobre.
Muy claro y entendible… gracias
Gracias Fredy ese es el objetivo
Hola! Por favor un ejemplo Para explicar dilatacion de Los cuerpos, gracias.
Cualquier cuerpo que reciba calor experimenta una dilatación. Por ejemplo un alambre de cobre si recibe calor aumentara de longitud.
por fa envienme todas las formulas de la termodinamica
Las que expuse son las que tengo
Está re buenísima la información, felicidades Ing. Químico, ÁNIMOS Y ADELANTE!! ES MUY BUENA OBRA PARA JÓVENES ESTUDIOSOS….
SALUDOS
Gracias. Soy Bioquímico, no Ingeniero. Cuando gustes te espero en el sitio.
necesito hacer un trabajo de fisica sobre la calorimetría y necesito saber a que se debe la calorimetría.
Como a que se debe?. Podes ser más específica?.
Lo que me desagrado mucho es que tiene faltas de ortografía muy graves.
Y como es posible que lo publiquen para ayudar a las personas si es pésima su ortografía.
Primero hola. Es bueno y educado saludar antes de comentar. Lo revisaré. Haber que tantas hay. Lo importante es el contenido, pero obviamente lo revisaré.
hola …necesito precentar un experimenro de calorimetria que puedo hacer
Armate un calorímetro.
Gracias!! A pesar de que lei Chang y Brown tenía demasiadas dudas! Gracias por tomarse el tiempo de explicar estos temas!! Genio!!
Gracias a vos por tu hermoso y alentador comentario.
Muchas gracias por la información, me a servido de mucho! 🙂
Me alegro mucho Seli. Exitos
Me aclaró bastante, gracias!! Yo estoy en 1er año de bioquímica recién. Saludos !!
Hola, me alegro.
Gracias, Me mareo en clases, entiendo mejor cuando leo XD. ( Repasando antes de ir a clases 🙂 ) Entendi todo menos de donde sale el Ce, podrias decirme ?
En el primer problema el CeCU y CeH2O
Es una constante que depende del material
gracias por tu explicacion
me sirvió mucho,
Gracias Joni
Una consulta, cuando la incógnita es la Ti de uno de los compuestos, el procedimiento de resolución es el el mismo? Muchas gracias!!
Claro que si
Me sirvió un montón esto muy bien explicado excelente muy recomendable mil gracias
Abrazo David
Muy buena explicacion y lo felicito por hacer la fisica muy entendible!
Gracias Guilleee
es que mi profesora dijo que explicara el concepto de calorimetria y dice que son dos pero no entiendo, me ayudaria? a y ademas necesito las aplicaciones de calorimetria entonces si es que usted me diera la respuesta de que responder se lo agradeceria mucho, es para un trabajo. gracias
yo se de un solo concepto. Lo que escribí allí es todo lo que se.
Tu redacción es una mrd… no tiene totalmente coherencia y cohesión.
Sos un desubicado. Si no te gusta busca otras páginas. Lee los comentarios y verás que si le sirve a la gente. Lo mejor que podes hacer es irte no aportas nada.
Hola, gracias por el artículo. Sólo un detalle me confundió: faltó el signo menos en 6,36 Tf con lo cual el resultado es Tf = 22,65 ºC y no 23,92 ºC
Lo demás, excelente.
Gracias Héctor. Puede ser, cuando pueda lo revisaré.
Hola! El sitio es de mucha ayuda. Me gustaría que dejara su nombre completo en vez de un seudónimo para poder citarlo de manera formal en algunos trabajos. Muchas gracias.
Hola María. Bioquímico Patricio Arroyo.