Los peróxidos básicamente son aquellos óxidos en los que hay una mayor proporción de oxígeno en la molécula. La diferencia radica en que en estos compuestos dos átomos de oxígeno se encuentran unidos entre si. Por ejemplo veamos al peróxido de hidrógeno (H2O2), que es el más conocido.
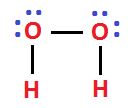
Cada línea representa un par electrónico de enlace covalente común. Por lo tanto en cada oxígeno quedan dos pares de electrones no compartidos. En estos casos el oxígeno utiliza el número de oxidación -1 en lugar de -2 como en los óxidos comunes. También existen peróxidos orgánicos pero no los explicaremos en este artículo.
Otros ejemplos para que les queden más claros:
Na2O2: Peróxido de Sodio
Li2O2: Peróxido de Litio
MgO2: Peróxido de Magnesio
PbO4: Peróxido Plúmbico, Peróxido de Plomo (IV), Tetraóxido de Plomo.
En el último ejemplo usamos los tres sistemas de nomenclatura de la misma manera que se usan en los óxidos comunes.
Algunos usos de los más comunes que encontramos en los peróxidos tienen que ver con su poder desinfectante. Al liberar oxígeno este actúa eliminando a las bacterias o sea, es bactericida. Así que se pueden desinfectar superficies de trabajo o que se utilicen con frecuencia. En medicina se lo conoce más como agua oxigenada para desinfectar instrumental quirúrgico o de enfermería. También por su poder oxidante se utiliza como quitamanchas siendo eficaz por ejemplo contra las manchas de sangre.
que seria una union atomica de un peroxido?
En los peróxidos los átomos de oxígeno s eunen con otra valencia. En lugar de 2 usan la 1.