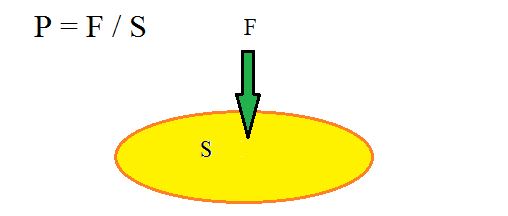
La presión es la relación que existe entre la fuerza aplicada y el área sobre la cual actúa dicha fuerza.
Este concepto esta representado por una sencilla fórmula.
P = F / S
P = Presión
F = Fuerza aplicada
S = Superficie o área
Solo debemos dividir el valor de la fuerza por el valor del área y listo.
Lo que podemos observar es que a medida que aumenta la Superficie la Presión disminuye manteniendo el valor de F. Si la S disminuye la P aumenta. Lo podemos observar en varios ejemplos de la vida cotidiana. Cuando algunos andan en esquíes la superficie de apoyo aumenta por dichos esquíes disminuyendo la presión. Por este motivo nadie se hunde en la nieve con esquíes. De forma contraria podemos ver que algunas mujeres que visten tacos en punta tendrán mayor probabilidad de hundirse en un suelo de tierra ya que la S disminuye aumentando la P.
Las unidades obtenidas de presión por supuesto dependerán de las unidades que tengan F y S. Así que podremos ver bastante diversidad. Sin embargo las más vistas son:
Kg/m2, Kg/cm2, gr/cm2, N/m2 (Pascal) entre otras.
La presión que aparece en los gases utilizan con más frecuencia unidades como la atmósfera o los mmHg (milímetros de mercurio).
Ejercicios:
1) Calcula la P ejercida por un cuerpo de 32 kgf sobre una S de 2 cm2
P = F/S P = 32 Kgf/2cm2
P = 16 Kgf/cm2
2) ¿ Que F habrá ejercido un cuerpo de 2 dm2 de base si ejerció una presión de 800 N/m2 ?.
De P = F/S despejemos F quedando
F = P x S
Debemos hacer el pasaje de unidad de superficie de dm2 a m2 para que las unidades se cancelen correctamente. 2 dm2 = 0,02 m2
F = 800 N/m2 x 0,02 m2
F = 16 N
Buenas tardes, necesito ayuda con mi tarea de química; estoy viendo ESTEQUIOMETRÍA y no sé cómo hacer el ejercicio que me dejaron.
El ejercicio:
Calcula el número de moléculas que hay en 20 gramos de hidrógeno gaseoso (H2)
Hola. No es el post correcto para esta pregunta ya que aquí hablamos de presión. Entra aquí para que veas el post que dedique especialmente a estequiometría.
https://quimicayalgomas.com/quimica-general/estequiometria/
En tu ejercicio que pasar la masa de 20 grs. a moles. Para eso debes dividir a los 20 grs por el peso molecular del hidrogeno, ahí lo pasas a moles y luego lo multiplicas por el número de avogadro y obtendrás las moléculas. Entra al link que te deje porque verás muchos ejercicios como los que buscas.
hola disculpe no puedo con un ejercicio de gases necesito ayuda ejercicio: un manometro de tubo abierto ue contiene mercurio esta conectado a un recipiente con gas ¿cual es la presion del gas confinadoen mm Hg en cada una de las situaciones siguientes? a)El mercurio en la rama conectada al gas es 4.5 cm superior a la rama abierta a la presion atmosferica que es 0.955 atm b)El mercurio de la rama de la rama conectada al gas esta 3.8 cm abajo del mercurio en la rama abierta a la atmosfera; la presion atmosferica es 1.02 atm.
Perdona pero la realización de ejercicios es parte de nuestro servicio con cobro.
Hola buenas noches quiero saber quien me ayuda a entender la ley de gas ideal
Busca gases ideales en este blog que esta bien detallado.
Muchas gracias me sirvió de mucho esta información
De nada Aura.
buenas tardes,me prodian decir que es el aumento de la presion y disminuye presion
No se te entiende la pregunta.