En química vemos dos tipos de uniones químicas. Las interatómicas y las intermoleculares.
Uniones Interatómicas: Son las que se establecen entre los átomos. Hay de tres tipos. En dos de ellas, las llamadas Iónicas ycovalentes, los átomos tratan de llegar a completar el último nivel con ocho electrones cumpliendo con la clásica teoría del octeto de Lewis. La otra es la Unión metálica que se establece entre átomos iguales del mismo metal.
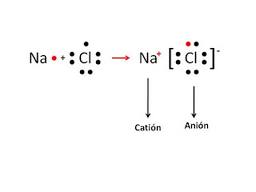
Uniones Iónicas: Aquellas que se realizan entre metales y no metales. Donde la diferencia de electronegatividad es importante. Ejemplos típicos lo constituyen los metales del grupo 1 o 2 con los no metales del grupo 7. Ej: Sodio con Cloro o Calcio con Bromo.
En estas uniones los electrones no se comparten sino que se ceden y se captan de forma absoluta, es decir, los metales electropositivos ceden electrones adquiriendo cargas positivas por tener protones en exceso. Y los no metales electronegativos los aceptan y completan así su último nivel energético. Se forman así cationes positivos y aniones negativos.
Propiedades:
Las propiedades que distinguen a los compuestos iónicos son:
*Tener puntos de fusión y ebullición elevados.
*Ser solubles en solventes polares como el agua.
*Forman estructuras de redes cristalinas duras.
*Presentan alta conductividad eléctrica en soluciones acuosas por ser iones.
Veremos un caso típico de una unión iónica. El sodio del grupo 1 con el cloro del grupo 7. Tienen bastante diferencia de electronegatividad. El sodio le cede al cloro el único electrón que tiene en su última capa o nivel energético. De esta manera el cloro completa su último nivel con ocho electrones. Quedan formados el catión sodio y anión cloro.
Este tipo de estructuras representadas con los electrones de la última capa, se denominan estructuras de Lewis. También las usaremos para las uniones covalentes.
Otro ejemplo: El Calcio, del grupo 2, se une con otro del grupo 7, en este caso el Yodo. Los 2 electrones del calcio son cedidos a los dos átomos de Yodo, que tienen 7 electrones en su último nivel. Llegando de esta forma al octeto propuesto por Lewis.
Antes de continuar con las uniones covalentes te dejo el video de uniones iónicas para que no te quedes con dudas.
Uniones Covalentes:
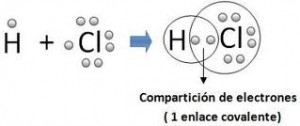
En este tipo de unión los no metales se unen con los no metales. Se da entre los átomos con poca o nula diferencia de electronegatividad. Y a diferencia de las uniones iónicas no se forman iones. Las uniones se establecen por la formación de pares electrónicos, de los cuales, cada electrón del par es aportado por uno de los átomos que forman dichas uniones. Los electrones se comparten, no se ceden o se captan totalmente. Esta es otra gran diferencia con respecto a la unión iónica en donde los electrones se ceden totalmente de parte de los cationes.
Algunas características que presentan los compuestos covalentes son:
Presentar bajos puntos de fusión y ebullición
Ser insolubles en solventes polares como el agua y el alcohol.
Ser solubles en ciertos solventes orgánicos
No formar iones
Aquí vemos un ejemplo de una unión covalente entre el oxigeno y el carbono. Podemos ver la formación de dos pares dobles de electrones, ya que cada unión está formada por cuatro electrones en total. Dos de ellos los aporta el carbono y los otros dos el oxígeno. Tanto el carbono como el oxígeno llegan a ocho electrones en total.
Otro ejemplo lo constituye la unión entre el oxigeno y el azufre. En este caso se da entre estos un tipo de unión covalente algo distinta. Ya que como observamos, el azufre le presta dos electrones al oxígeno, es decir, que el par electrónico esta vez está constituido por el aporte de un solo átomo en lugar de dos átomos como de costumbre. Este tipo de unión se llama covalente dativa porque un solo átomo es el portador del par electrónico. También se la llama covalente coordinada. Cabe destacar que si bien el par es cedido por uno de los dos átomos, este no lo pierde sino que lo presta. La otra unión en la parte lateral del esquema es una unión covalente doble común.
Cuando dos elementos se unen en la unión covalente se da otro fenómeno que merece también ser considerado. Si bien no son uniones iónicas y no veremos la formación de iones con sus cargas expuestas, al existir diferencia de electronegatividad cuando son distintos, el par electrónico queda más cerca del elemento más electronegativo.
Un ejemplo lo constituye la unión entre el cloro y el hidrógeno.
El par electrónico formado por dos electrones aportados uno por cada átomo esta muchos más inclinado hacia el cloro que es el elemento más electronegativo en este ejemplo.
Obviamente que si se trata de una unión en la que ambos tienen la misma electronegatividad el o los pares electrónicos estarán ubicados en el medio o en la zona central de los núcleos atómicos. Como ejemplos podemos citar a las moléculas biatómicas de oxígeno, hidrógeno, nitrógeno, etc.
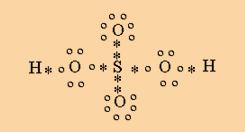
Acido Sulfúrico:
Aquí vemos dos uniones covalentes dativas entre el átomo de azufre y los dos oxígenos que están por encima y por debajo del azufre (dos asteriscos negros). El resto son uniones covalentes simples y comunes.
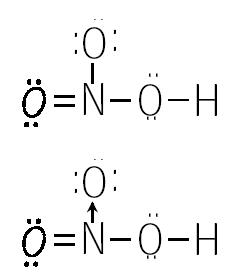
Veremos un ejemplo más de unión covalente. Esta vez con tres átomos distintos. Representaremos a la molécula de ácido nítrico. (HNO3).
Observamos que el átomo de nitrógeno aporta un par electrónico o sea una unión dativa entre el nitrógeno y el átomo superior de oxígeno.
Tenemos una unión covalente simple entre el nitrógeno y el oxigeno, otra covalente doble entre estos mismos átomos y una covalente dativa desde el nitrógeno al otro oxígeno.
Antes de comenzar con unión Metálica te dejo el video de Uniones Covalentes. No te lo pierdas.
Unión Metálica:
En las uniones metálicas, los átomos se mantienen unidos gracias a que sus núcleos positivos están rodeados de una nube de electrones en permanente movimiento. Adquieren una forma de red tridimensional donde los nudos están representados por los núcleos atómicos y estos están rodeados por otros. Esta característica es la responsable de algunas propiedades de los metales como ser excelentes conductores de la electricidad y tener cierto brillo.
A continuación vamos a desarrollar un tema que nos sirve para entender la polaridad de las moléculas covalentes. Geometría Molecular y Geometría electrónica.
Cuando analizamos algunas moléculas y llegamos a la conclusión de que son polares debemos analizar las causas.
Debemos comentar básicamente la Teoría de la repulsión de los pares electrónicos de valencia.
Esta teoría establece que los pares electrónicos compartidos entre átomos y los no compartidos guardan entre si la máxima distancia posible por la repulsión entre cargas negativas. Si por ejemplo estamos en presencia de solo dos pares electrónicos estos se separaran unos 180°. Si tenemos tres pares en total, se separaran formando 120° de separación entre sí y así sucesivamente. Esto ayuda a establecer la geometría molecular y electrónica que tendrán los compuestos covalentes en el espacio.
Lo que determina que un compuesto sea polar es la magnitud de una cantidad vectorial llamada momento dipolar. Cada átomo que se une con otro distinto determina un momento dipolar. La suma de los distintos momentos de cada enlace entre el par de átomos va a dar como resultado el momento dipolar resultante de la molécula. Si la resultante da cero, concluiremos que la molécula será no polar, así no sean cero los momentos individuales. Esto sucede porque los momentos se anulan entre sí por ser de igual intensidad y de sentido contrario. La geometría molecular y electrónica como vemos es un factor trascendental.
Es bueno entender la diferencia entre las dos geometrías. Cuando hablamos de G.E. nos referimos a la disposición espacial que toman todos los pares electrónicos, los compartidos y los no compartidos. En cambio en la G.M. se refiere a la disposición que forman los pares electrónicos de enlace, sin tener en cuenta a los pares de electrones no compartidos.
Por ejemplo.
En el CO2, el carbono se halla unido a dos átomos de oxígeno. Los dos momentos dipolares se dirigen vectorialmente hacia los átomos de oxígeno ya que son más electronegativos que el de carbono. Estos vectores son de igual magnitud pero de distinto sentido por lo tanto se anulan al formar un ángulo de 180°. La molécula CO2 resulta ser no polar. La G.M. coincide en este caso con la G.E. ya que no hay electrones no compartidos. Esta geometría es lineal.
O ← C → O
En el caso del agua, como se vio anteriormente. Podemos ver que hay cuatro pares de electrones, dos compartidos y otros dos no compartidos pertenecientes al oxigeno. La máxima repulsión entre estos cuatro pares en total genera una geometría electrónica tetraédrica.
El ángulo máximo de separación en estos casos es de unos 109 grados aprox. Es el ángulo que hay entre los dos átomos de hidrógeno. Los dos dipolos que hay entre los átomos de hidrogeno y el de oxigeno apuntan hacia el oxigeno que es el elemento más electronegativo. Por lo tanto no se eliminan. Esto hace que la molécula de agua sea polar.
Aquí hay una diferencia entre las dos geometrías. La G.E. es tetraédrica, pero la G.M. es angular ya que se consideran solo a los dos enlaces O-H.
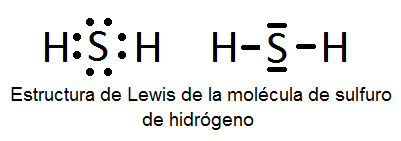
Otro caso es el del H2S.
Cada línea representa un par electrónico. Hay dos entre el azufre y cada hidrógeno y otros dos pares sin compartir del azufre que ocupan un importante espacio y hace que cambie la forma de la molécula adquiriendo una forma de tetrahedro.
Los pares compartidos son dipolos con el sentido hacia el azufre.
La geometría electrónica (G.M.) está representada por un tetraedro y la geometría molecular (G.M.) es angular. En este caso hablamos de unos 109° aprox. Algo menor que el agua. Esto sucede porque los pares electrónicos libres que no forman enlaces ocupan un poco más de espacio que en el oxígeno.
En el caso del amoníaco (NH3), el nitrógeno tiene tres enlaces con los hidrógenos formando tres dipolos orientados hacia el nitrógeno. Tiene otro par electrónico sin compartir. Por lo tanto deducimos que si hay cuatro pares de electrones en total, la G.E. será tetraédrica. La G.M. es trigonal piramidal. El ángulo de enlace es algo mayor que el del agua y sulfuro de hidrogeno por tener solamente un par no compartido de electrones en lugar de dos, ocupando menos espacio. Hablamos de un ángulo de 107° algo mayor que los 104.5° que hay en el H2O y el H2S.
Uniones intermoleculares:
Son más débiles que las interatómicas. Podemos clasificar a las uniones intermoleculares en tres tipos.
Unión Puente de Hidrogeno y Fuerzas de Van der Waals. Dentro de estas últimas tenemos Las fuerzas de dispersión o de London, y las interacciones dipolo-dipolo o dipolo-dipolo inducido.
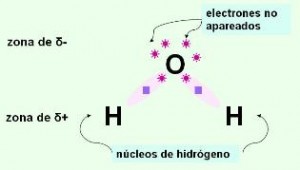
Puente de Hidrógeno: Es la más fuerte de las intermoleculares y es la responsable del alto punto de ebullición que exhiben moléculas como el agua. Se da mucho en aquellas moléculas que tienen átomos de hidrógeno. El ejemplo más común es la molécula de agua. (H2O). Representemos primero le estructura electrónica de esta molécula.
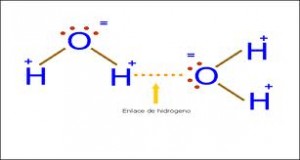
Observamos que el átomo de oxígeno tiene dos pares de electrones sin compartir y que además los dos pares electrónicos que forma con los hidrógenos están más cercanos al oxígeno. Estas circunstancias convierten al oxígeno en un átomo con una densidad de carga considerablemente negativa así como una densidad de carga positiva rodeara a los átomos de hidrógeno.
Esto generará atracciones con moléculas vecinas de agua formando una enorme red asociada. Las uniones se establecerán entre átomos de hidrógeno de unas moléculas con átomos de oxígeno de otras.
También otras moléculas que tienen este tipo de unión son por ejemplo HCl, H2S, y los alcoholes ya que poseen el grupo oxhidrilo (OH–).
Fuerzas de Van der Waals.
Las fuerzas de Van der Waals son fuerzas menos fuertes que las de puente de hidrógeno. Su naturaleza es eléctrica y aparece como consecuencia de la aparición de dipolos permanentes o transitorios en moléculas vecinas. En las de dipolo permanente cada molécula constituye un dipolo y su parte positiva se une con la parte negativa de la molécula vecina. Es decir, que este tipo de unión se da solo en las moléculas polares. En las uniones de dipolo transitorio, cada molécula es un dipolo por un período muy corto de tiempo. Estas uniones también se conocen como fuerzas de London. No son moléculas polares por tener una distribución electrónica muy simétrica alrededor del núcleo atómico. Sin embargo, en algunas circunstancias, estas moléculas pueden cambiar su distribución simétrica por algún choque contra el recipiente o con moléculas vecinas apareciendo los dipolos momentáneos y las interacciones con moléculas vecinas. Cabe aclarar que las fuerzas de London existen también en todas las moléculas polares ya que estas igual experimentan corrimientos en sus nubes electrónicas. Pero en las moléculas no polares son las únicas fuerzas intermoleculares que existen.
En otras ocasiones se pueden generar también dipolos inducidos por la aproximación de una molécula polar hacia otra no polar. La polar inducirá un dipolo en la molécula no polar.
Bioquímico: Patricio Arroyo.
Fundamentos de Química Orgánica
Propiedades Periódicas de los Elementos
Estructura Atómica y Configuración Electrónica
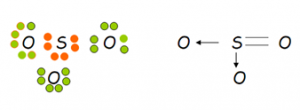

Necesitaba saber si las uniones covalentes no conducen electricidad por no formar iones?
No Camila. Justamente al ser covalentes y no formar iones no conducen la electricidad. Ya que esta para ser conducida necesita un medio con cargas.
Me podrías dar la definición? Te lo agradecería
Definición de que?.
NECESITO SABER SI LAS UNIONES COVALENTES TRANSMITEN ENERGIA
Que pregunta estúpida. Todo transmite energía.
hola,como seria la union quimica de PbO?
Iónica
Si es iónica, ¿por qué no es soluble en agua?
Oe ctm se supone que tu eres quimico , no nosotros , porque le dices que pregunta estupida? Si no sabemos , por algo preguntamos no?
A quien le dije eso Gary?.
¿Que sucede y que tipos de compuestos forman cuando dos elementos tienen grandes diferencias de electronegatividad?
Hola Luciano. En esos casos forman uniones iónicas.
No c soli… Y tu??
Perdoname Cami. Despues de años me di cuenta de que mo te había leído bien. Estas en lo correcto. Al no formar iones no pueden conducir la corriente eléctrica. Besos y felíz alo nuevo.
buenas, me podes explicar basicamente en que consiste la teoria de Lewis respecto a las uniones quimicas, miles de grcias
Hola queria saber cuantas uniones químicas hay y un ejemplo de cada una es para una tarea me encanta la quimica me ayudas
En el artículo dos los ejemplos Joaquín.
No
Muy interesante tu pagina!
hola quisiera saber que uniones quimicas se produce cuand o se unen dos atomos de hidrogeno para formar una molcula
Covalente Paola. Tengo el artículo Uniones Químicas ahi puedes verlo.
La unión es covalente porque ambos átomos son iguales y no existe diferencia de electronegatividad
Hola como se llama las rayas que están al. Rededor de los atomos
de los átomos? o de los núcleos?. Si es de los núcleos serían los electrones.
se llaman órbitas o sub orbitas
hola quimico pe podrias dar información sobre la escala de electronegatividad y la polaridad de los enlaces covalente. muchas gracias
Las escalas las encontrarás en las tablas.
Se llaman orbitas
hola y no se que es esto
hola los metaloides en las uniones entran como metales ó no metales? por ejemplo boro y carbono seria covalente? como hago la estructura de lewis? gracias..
Metaloide entra como metal
entra en el grupo de los metales
Hola, quería saber que tipo de unión se establece entre el alumio y el azufre. Ya que su diferencia de electronegatividades no justifica una union ionica. Por otro lado son dos especies distintas, metal no metal, por lo que tampoco justifica una union covalente, me podrían ayudar?
Gracias!
No es tan exacta la diferencia entre covalente o ionica. Se basa mas en la diferencia d eelectronegatividad. De hecho con diferencia nula tambien se unen compuestos como en la covalencia. Hay una diferencia entre estos dos elementos. Entre estos creo que el sulfuro de aluminio se forma bien. Al2S3
hola quisiera saber en que pueden diferenciarse 2 atomos de un mismo elemento? en el numero de protones¡? en el numero de neutrones¡? en el numero de electrones o en el numero masico??? desde ya muchas gracias!!!!!
Hola Mónica. Mira dos átomos del mismo elemento básicamente no se diferenciaran salvo que sean isótopos. Los isótopos son átomos de un mismo elemento y se diferencian en la cantidad de neutrones. O sea en el número másico. Nada más.
no se diferencian
queria saber que significa que una molecula sea de uniones simples, dobles, o triples, y si podes dame ejemplos de esas, gracias
Hola Manuel. Por ejemplo la molécula de oxígeno esta formada por la unión de 2 átomos d eoxígeno y entre ellos hay dos enlaces covalentes o a veces llamado un enlace doble. En el caso del H2 (hidrógeno), son 2 átomos unidos por un enlace simple. En el N2 hay tres uniones simples o una triple. En el post doy ejemplos
cuales son las diferencias entre sustancias y quimicas y sustancias compuestas?
me podrias dar un ejemplo?
Sustancias químicas son todas. Despues las diferencias entre simples y compuestas. Las simples están formadas por un solo elemento y las compuestas por mas de uno
hola
que bien
Regla De Octeto
es cuando los elementos quieren ganar perder elctrones para poder adquirir 8
consulta
q tipo de uniones hay y por q ??
BrK H2SO4 Ag
y q propiedades de las sustancias se pueden justificar x el tipo de union ???
si alguien me ayuda porfi
En la primera ionica porque es un metal con un no metal. En la otra covalentes ya que son todos los átomos no metales. Eso ño explico bien. Hay que leer.
QUERIA SABER SI LOS IONES SON METALES? SALUDOS
pueden ser metales o no metales. Lee un poco por favor.
Propiedades químicas del Hierro
Hay muchas. Es un metal conductor de la electricidad perteneciente a los metales de transición en la tabla periódica. Se combina con el oxigeno con facilidad roduciendo los óxidos que se conocen. Entre otras propiedades.
Union covalente entre oxigeno y nitrogeno ?
Si es covalente
hola como se forman las uniones quimicas ?
Lee el post
Esta pagina me hizo aprobar en diciembre c:
No sabes cuanto nos alegra. Recomendala a tus amigos y compañeros
Hola, en que unión se forma iones y como lo represento en una respuesta?
Hola Alejo. En las uniones iónicas. Ahi lo explico con detalle. Con el diagrama o representación de Lewis de puntos
Hola,me podrias explicar exactamente cual es la diferencia de uniones quimicas?
Hola. Diferencia?. Basicamante estan las covalentes y las iónicas. Ahi estan explicadas de forma concreta. Decime especificamente cual es tu duda
De cuántas maneras podemos graficar una unión química ?
DIGA Y EXPLIQUE que elementos de las siguientes duplo,es mas electronegativo.
cl/ca fe/na f/h
Alguien que me ayude por favor.
Hola. Te referiras a que dupla presenta mayor diferencia de eectronegatividad. Debes consultar en una tabla de electronegatividades y restar los numeros o valores de cada dupla. El que tenga mayor diferencia tendra mayor diferencia de electronegatividad.
Muy buena explicacion, me sirvio bastante para entender las uniones covalentes e ionicas, pero tengo una pregunta, cómo hago para resolver uniones ionicas con paréntesis? Por ejemplo Al (OH)3
Hola. Bueno no es muy distinto. Del Al salen tres uniones a los oxígenos y estos unidos a cada hidrógeno. El Al le da cada uno de los 3 electrones a los tres oxígenos siendo tres uniones iónicas. las uniones de los oxígenos y los hidrógenos son covalentes.
por que algunos átomos tiene mayor tendencia a formar enlaces iónicos que covalentesy otros a formar enlaces covalentes?
Hola andre. depende de la diferencia de electronegatividad. Si hay bastante diferencia serán uniones iónicas sino covalentes. Aprovecho a informarte que ya esta a la venta el libro electronico de química q tiene toda esta info q buscas y mas con ejercicios resueltos. Si estas interesada contactame.
Muy buen aporte. Una consulta, en las uniones intermoleculares,por qué o como se producen las uniones dipolo-dipolo, dipolos inducidos y dipolos transitorios? Muchas gracias!
Hola Cintia si lees entero el erticulo verás que hablo de los dipolos
tengo un representación de la unión entre dos atómos de agua (H2O) en donde se unen H y O , estoy por entregar el trabajo y tengo la duda si es un puente de hidrígeno o no. graciasssssssssssss
En la moléculas de agua no hay ningún puente de hidrógeno en realidad los puentes se establecen entre las moléculas de agua como explico. Por ej entre un oxígeno de una molécula y el hidrógeno de otra molécula vecina. Pero nunca dentro de la misma molécula.
Vos habrás querdo decirme entre dos moléculas de agua cuando me dijistes mal entre dos átomos de agua ahi esta el error.
como es la union de Ca(NO3)2???
Entre el calcio y el resto es iónica porque es metal con no metal. Entre N y O es covalente
Por favor tengo una duda el enlace del NO2 es covalente sencillo, doble o tripe? Es que estoy confundida
Básicamente es covalente, ahora no cerraría como estructura de lewi para llegar a 8 electrones por átomo. Quizá si como ión.
-pvc
-acero
-bronce
-nitrogeno(G)(N2)
-CO2
-alpaca.
describa que tipo de uniones son cada una?.(intermolecular /interatomica) dentro de las cuales q tipo de uniones se dan?
pvc covalentes ya que es un polímero orgánico. acero nose si alcanza a ser ionica ya que habría entre C y Fe pero no hay tanta diferencia de electronegatividad. Bronce es una aleación, es metálica. N2 es covalente e interatómica obvio. CO2 covalente interatomica. Alpaca nose de que esta hecha pero es orgánica asi que debería ser covalente
Esta pagina es excelente ya que posee gran variedad con respecto a la química . :3
una pregunta ..??? q tipo de uniones se dan entre las moleculas de agua? muy bueno la pajina.
Hola, justamente ahi lo explicamos. Las moléculas de agua se unen a través de uniones puente de hidrógeno entre lo hidrógenos de algunas con los oxígenos de otras. Lee esa parte que la explico bien.
me podria explicar en ¿que tipo de uniones se dan entre las moleculas de agua? gracias
Son uniones puente d ehidrógeno, lee eso en el post que esta bien desarrollado y con ejemplos.
si es covalent xq?
ahi esta aclarado cuando es covalente
hola buenas tardes. muy buena la pagina…
Gracias Leandro
Esta muy buena la pagina y explicas re bien.
Gracias Micaela
Me podes decir todas las características o propiedades que posee cada unión?
Están en el post Cristian. Por ej las iónicas se hacen entre metales y no metales. En cambio las covalentes entre no metales. Busca las demás y escribimelas a ver si estamos de acuerdo.
hola tenes ejersicios de uniones ionicas y covalentes para practicar , porque me van a toar eso y quiero practicar gracias
Pronto lanzaremos un video con ese tema
Definicion de radio atomico, radio ionico, energia de inizacion, potencial de inizacion, electronegatividad. Muchas gracias.
Entra al post de propiedades periódicas
una pregunta la composición de los cuerpos es afectada de igual forma por fenómenos físicos o quimicos
Son fenomenos diferentes. Los químicos afectan a la composición. Los físicos no.
Me ayudo muchísimo,muchas gracias!
hola te queria preguntar ..si sabrias algo sobre las uniones mas resistentes y las uniones menos resistentes, es tarea de quimica pero no encuentro ninguna definicion .
Bueno, las uniones más fuertes son las iónicas, y las meno resistentes las covalentes.
necesito saver que forma una convinacion de bromo y calcio
La sal bromuro de calcio. CaBr2
Hola quería saber que unión van a formar los elementos de calcio y nitrógeno y porque…gracias
Ionica porque es un metal con un no metal. Exitos
hola tengo un trabajo integrador dice INDIQUE LAS UNIONES UIMICAS QUE SE PRODUCEN CUANDO EL LITIO SE COMBINA CON EL CLORO
Hola Claudia. Es una unión iónica por excelencia. Ya que es un metal con un no metal y tienen en este caso bastante diferencia de electronegatividad.
Litio grupo 1 le da su electrón al cloro, quien llega a su vez a 8 electrones en la última órbita. Litio queda con una carga positiva (catión) y al cloro será el ión cloruro (anión)
Hola, muy buena la página.. Quisiera que significado tiene:
*Covalente apolar
*Covalente polar
Gracias. Covalente polar es cuando el par electrónico esta más cerca de uno de los átomos que hacen a cierta unión. Porque acordate que la diferencia de electronegatividad hace que los electrones se acerquen más a un átomo que a otro.
quiero saber cual es el tipo de unión química que se da entre los metales??? como se llama?
Unión Iónica.
una pregunta que sucede cuando se produce una unión química?
Se genera un compuesto Melanie o una nueva sustancia.
Muchas gracias me re sirvió y esta muy bien explicado
Gracias Facundooo, abrazooo
Hola! Muy buenos los resúmenes, me resultaron de gran simplicidad comprenderlas.
Genial Sofía. Ese es el fin.
Hola me gustaria saber que tipo de union existe entre CaH2.
Iónica ya que entre metal y no metal
Hola quisiera saber porqué se unen los elementos
Es una necesidad y un lindo milagro sino no existiría la vida como la vemos ni nada similar. Ahí explico los distintos tipos de uniones que hay.
Hola. Me podría decir que tipos de enlaces puede formar el aluminio???? y un ejemplo por favor. De antemano gracias.
Hola, de antemano te digo que depende con quién lo haga pero básicamente al ser un metal puede hacer uniones iónicas al unirse con un no metal como cloro, oxígeno, etc
¿como se llaman los compuestos formados en las uniones quimicas?
que sea rapida la respuesta.. la necesitaas yaa!! 😛
Compuestos químicos, es una pregunta muy general, hay muchos tipos distintos de compuestos.
esta pagina me ayudo con mi trabajo practico un 9! que linda pagina
Gracias Belen.
quisiera saber ¿en que consisten las uniones quimicas?
Uniones entre átomos lee el post ahí lo explico bien.
hola el boro, berilio, magnesio, fosforo, carbono y oxigeno pueden formar uniones quimicas
Por supuesto, todos los elementos salvo los gases inertes forman compuestos.
Me podría decirque unión química se produce cuando el litio se combina con el cloro
Hola, sin dudas iónica. Metal con no metal.
Me podría decirque unión química se produce cuando se unen dos átomos de hidrógeno para formar una molécula
Sin dudas covalente ya que son dos no metales encima los mismos átomos.
Me Pueden Decir Que Union Se Forma El Potacio Y Oxigeno?
Que Caracteriza Esa Union?
Cual Es La Electronegatividad de Cada Elemento!
Cuantas Clases De iones Aparecen?Como Se Llaman!
es iónica ya que es un metal y un no metal. Los valores de las electronegatividades las encontraras en cualquier tabla periódica.
Hola muy buena la página, quería saber bien que son las fuerzas de London?
Hola ahi hago referencia en el post.
Quiero saber la covalencia del N en el HNO3. Q relación hay entre covalencia, estado oxid y pares de e compartidos.
El N tiene 4 enlaces ,uno de ellos dativo. Usa la covalencia 3?
El N en el HNO3 trabaja con estado de oxidación +5. Te dejo este post que escribi y esta en ese sitio mío. Lee y entenderás bien como se saca y que es el número de oxidación.
http://www.quimicayalgomas.com/quimica-general/reacciones-redox-metodo-del-ion-electron/
Genial esta pagina, todo muy bien explicado de forma simple. Muchas gracias Patricio!
De nada Nico
Me gustaria saber la relacion entre covalencia y pares de electrones compartidos. La covalencia del N en el acido nitrico es 5 ? Comparten 4 pares. Es 3 y uno de ellos dativo?
Gracias
Hola, estas en el post equivocado, entra aca que es el post que escribi del tema.
http://www.quimicayalgomas.com/quimica-general/reacciones-redox-metodo-del-ion-electron/
Hola! Que átomos son diatómicos? El N2, O2,H2, …cdo se usa el H2? Solo en hidratos?
son moléculas di o bi atómicas. O2, N2, H2, Cl2, Br2, I2, F2.
Hola ! Queria preguntarle cual es la diferencia entre union covalente molecular, y union covalente atomica ? me podria dar un ej, y algun ejercicio para hacer .. Gracias !
La unión covalente es covalente lo que vos querés decir es uniones intermoleculares, ahí es otro tipo d eunión como por ej las de puente de hidrógeno, etc.
Buenas, queria saber como se une por ejemplo el oxido y el hierro, para luego poner: Tradicional: seria… Oxido ferroso?
Hola, dirás el oxígeno y el hierro para formar el óxido. Es una unión iónica porque es metal con no metal. Depende de la valencia del hierro podrás tener FeO (óxido ferroso) o Fe2O3 (óxido férrico).
Hola Patricio! 🙂 Muy bueno tu blog. Quisiera que me ayudes, rindo química dentro de unos días y no me pude sacar la duda. La profesora me preguntó sobre UNIONES QUIMICAS y que le describiera que unión tenía el O2(Oxígeno). Y otra cosa porqué la unión covalente es POLAR, APOLAR Y DATIVA? ESPERO TU RESPUESTA. BESO GRANDE!!!!
La unión entre dos átomos de oxígeno es de carácter covalente. La polaridad la explico en el post, leelo completo. Exitos y perdona, no he tenido tiempo de contestar antes las preguntas. Besitos.
hola, necesito saber la union quimica del Br2O3
Es covalente ya que es entre no metales
que union se rompe cuando hierve el agua ??? y cuando se evapora??? y que diferencia hay en ambos procesos
Se rompe la unión puente de hidrógeno
EXCELENTE PAGINA! QUISIERA SABER COMO SE LLAMA LA PAGINA DE YOUTUBE PARA VER MAS VIDEOS? ES » EL SANTO»? GRACIAS!!
Hola sii tal cual. Aca te dejo el link
https://www.youtube.com/channel/UCWzKIkF6_U4poswb9qgfVgQ
Hola, te hago una pregunta cual seria la unión química que forma el Calcio y sus compuestos.
Me harías una gran ayuda. Gracias!!
Hola, mal hecha la pregunta. Es el calcio con otros elementos. Con cuales????
Patricio excelente la explicación en tan poco tiempo, te consulto que experiencia sencilla puedo realizar para comprobar estas uniones químicas…gracias
Experiencia ni idea Guille
como se representan las uniones químicas ?
Lee el artículo que explico y ejemplifico todo.
Hola ¿Me podrían ayudar, por favor? necesito saber que enlaces pueden formar los metaloides, si depende por la unión con un metal o un no metal, o si depende por la diferencia de electronegatividad entre los elementos. Me piden determinar el tipo de enlace entre el Si y el O, y hacer su símbologia.
Please, agradecería mucho que respondieran.
que tipo de union tienen:
A- CLORO CON HIDROGENO
B- SODIO CON AZUFRE
C- OXIGENO CON BROMO
D- POTASIO CON YODO
E. CALCIO CON FLUOR
F- HIDROGENO CON AZUFRE
G FOSFORO CON HIDROGENO
H- OXIGENO CON FOSFORO
I- HIERRO CON OXIGENO
LES AGRADECERIA QUE ME RESPONDAN! GRACIASSSS!
POR FAVOR RESPONDAAAAAN!!!!!!!!
Lee el artículo y sabras la respuesta para eso lo escribi.
A- Covalente
B- ionico
lee
Hola, pato. Che me llevé química culpa tuya.
No habrás estudiado. Asumí tu responsabilidad
Hola, repito la pregunta
¿Me podrían ayudar, por favor? necesito saber que enlaces pueden formar los metaloides, si depende por la unión con un metal o un no metal, o si depende por la diferencia de electronegatividad entre los elementos. Me piden determinar el tipo de enlace entre el Si y el O, y hacer su símbologia.
agradecería mucho que respondieran.
Hola buenas noches, quisiera saber como es la convinacion que forman las uniones metalicas, ionicas, covalentes? Es que el lunes rindo un examen y me interesaria saber y aprobar desde ya muchas gracias………
Que de gente irrespetuosa , mira que preguntar sin leerte el articulo…
Bien Valentinooo jaja por fin alguien me entiende. Gracias.
Necesito saber que especie química se forma a partir d la unión de dos átomos de diferente naturaleza
Tu pregunta es muy amplia y nada específica. Miles y miles de compuestos se forman con átomos diferentes.
Hola Patricio tengo una pregunta ¿cuánto mayor es la fuerza de unión en la capa electrónica K del tungsteno que… en la capa electrónica L , en la capa M o en los electrones libres?
No te entiendo estrella
en el caso de la union entre un no metal y un elemento de transicion dicha union seria considerada covalente o ionica?
Iónica
Queria saber, ¿ Que uniones quimicas se producen en la molecula del agua?. Gracias
Las moléculas de agua están unidas por uniones puentes de hidrógeno. Las explico bien en el artículo.
qué tipo de enlaces se obtienen al juntar el grupo llA con los del grupo VlA
Hola. Iónicos.
Que tipo de union quimica forman el carbono azufre hidrogeno nitrogeno calcio sodio al convinarse con el oxigeno
los no metales con oxígeno son covalentes. Los metales con oxígeno iónica.
Que propiedades poseen las uniones metálicas ?
Hola patricio, como le va ? Soy nahuel. Quisiera decirle con respecto a las orbitas, Son; 1S2-2S2-2P6-3S2-3P6 ?
Están ordenadas. Eso lo podes ver en cualquier tabla periódica o en la mayoría de ellas.
que tipo de union química forman los di polos químico?
Se da en las intermoleculares
Hola, una pregunta donde están las fuerzas de DIPOLO en las uniones interatomicas
Hola. Se mencionan Diego.
Cual seria la difinición de UNIÓN METALICA
No esta respondida?.
Que tipo de unión sería GaH3? Como hago para que cumpla la regla del octeto?
No conozco ese compuesto.
como se relacionan las caracteristicas de las uniones con sus propiedades?
Las uniones determinan las propiedades químicas. Polaridad, tipos de
enlace, etc.
De qué depende que se establezca una unión con otra?
De que sean compatibles químicamente. Por ejemplo los polares con los polares. Las sales son en mayor o menor medida solubles en agua por este motivo. Que ambos sean compatibles es porque hay asociaciones o interacciones entre las moléculas.
Necesito saber el caso especial que hay de uniones químicas es uno solo que hay que se hace de una manera distinta
Nose a cuál te referís
Tenés más datos Luana?.
como se representan las uniones químicas?
Como lo explico en el artículo.
Hola. Te hago una consulta. Para realizar la formula desarrollada de una sal. Por ej Ca3(PO4)2. Se puede realizar directamente graficando con enlaces simple o dobles las uniones entre O y P, y entre los O y los átomos de Ca?. O la unión entre los dos radicales fosfato «PO4» y los 3 Ca es mediante un enlace iónico? Gracias.
De ambas maneras.
que union quimica es el Sr2
¿Escribiste bien?.
Hola. Los metaloides que tipo de unión interatomica tienen ?
Consulta: Que tipos de uniones tienen:
Los óxidos ácidos, óxidos básicos, hidruros metálicos, hidruros no metálicos, sales hidroácidas.
Ionicas
Hola, tengo un trabajo practico que dice: ¿Que tipo de unión química poseen en general las sustancias orgánicas? Muchas gracias!
Hola Melanie. Covalentes.
entre que elementos se producen las diferentes uniones quimicas? alguien me ayudaa
Que otros nombres se le da a la unión covalente y a la unión ionica?
Son esos.