El Número de Avogadro es un concepto muy utilizado en Química. Sobre todo en Estequiometría.
Es un número enormemente grande, podríamos decir astronómico. El número es nada más y nada menos que 6,02 x 10^23, (potencia 23, unos 21 ceros después del 602), lleva su nombre en honor al brillante científico que lo descubrió, pero aquí explicaremos cual es su concepto. Es la cantidad de moléculas que contiene un mol de cualquier sustancia. Recordemos que mol es el peso molecular de un compuesto expresado en gramos.
Si se trata de un compuesto o un elemento diatómico (molecular), hablamos de moléculas. En el caso de los metales, hablamos de átomos. O sea, el número expresaría en estos casos a la cantidad de átomos contenidos en un mol de ese elemento metálico.
Por lo expuesto, el número de Avogadro se aplica a las sustancias moleculares y atómicas. Veremos algunos ejemplos.
El agua tiene como fórmula molecular H2O. Es decir, dos átomos de hidrógeno y uno de oxígeno. Si sumamos los pesos atómicos de estos elementos nos da 18 (16 de oxígeno y 1 de hidrógeno por los 2 átomos del mismo). El mol por consiguiente nos da 18 gramos. Por lo tanto, en estos 18 gramos existen una cantidad de 6,023 x 10^23 moléculas de agua.
Si estamos en presencia de 40 gramos de calcio (el valor de su mol), podemos asegurar que en esa masa, existen 6,023 x 10^23 átomos de este.
En el caso del ácido sulfúrico (SO4H2) el mol de este tiene un valor de 98 gramos. Por lo tanto existen allí 6,023 x 10^23 moléculas del ácido. Así de la misma manera lo aplicamos a todos los compuestos como óxidos, hidróxidos, ácidos, sales, etc.
Como vemos, es muy fácil entender el concepto del Número de Avogadro. En el post de estequiometría podrán ver mejor la aplicación a distintos ejercicios.
Te dejo el siguiente video donde te explico todo de nuevo y con más ejemplos para que lo entiendas mejor.
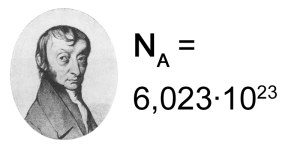
licenciado buenas tardes entonces eso quiere decir que moleculas se aplica para los elementos liquidos y atomos para elementos metalicos (solidos)? ejem: Au2O=197(2)+16=410g ~602 300 000 000 000 000 000 000 atomos de oxido cuproso?
Hola. Moléculas son elementos biatómicos o compuestos. Para la mayoría de los metales se habla de átomos
6.022 o 6.023 X10-23. Por que no tiene un solo valor?
En realidad es una variación despreciable ya que lo que más peso tiene son las primeras cifras y el exponente.
Hola necesito saber este ejercicio 1kgdesosa x cada l de agua que pesan 3kg.densidad de agua es 1g/ml)se obtiene4kg de solucion y se determina la densidad de esta solucion es 1,25g./ml
Hola. No se entiende nada el enunciado y no pones la pregunta.
Cuwl ES WL numero de avogadro
Cual ES el numero de avogadro
Ahí esta clarito en el artículo.
No leíste el artículo. 6,022×10 a la 23
Hola. Yo digo por ejemplo: una molécula de H2O pesa 18 gs. O sea elmol….su peso molecular..y tiene 6.02x 10a la 23( exponente) moléculas. La confusión es: una molécula de agua tiene 6.02x 10..23 moléculas de agua? Igual con un átomo. Un átomo de Na, por ej. De peso molec. 23 tiene 6.02x 10..23 átomos de Na? Cómo tendría que expresarme? Agradecería mucho su aclaración. Gracias
En un mol de un compuesto tenes el número de avogadro en moléculas.
una pregunta y si fueran 6 moleculas de acido sulfurico(6H2SO4) cuantas moleculas tendria?6 x el nro de av?
habrás querido decir 6 moles
entonces entiendo que si tengo 36.45 109.35 gramos de HCl
H= 1 HCl= 1+35.45 = 36.45 uma
Cl= 35.45 109.35gramos de HCl * 1 mol
_________________________________ = 3 moles de HCl
35.45 gramos/mol
3 moles de HCl * 6.022*10^23
_______________ = 1.8066*10^24 moléculas de HCL
1mol
¿es correcto?
No esta muy claro. En 3 moles de HCl hay esas moléculas si.
buenas profe, mi pregunta es ¿que concepto químico establece una equivalencia entre moles de un compuesto y numero de partículas que contiene? GRACIAS es para solucionar las dudas de un taller de 20 puntos👍😁
Hola. Justamente un mol contiene el N°de Avogadro en moléculas.
HOLA DOCTOR UNA PREGUNTA
CUAL ES LA UNIDAD EL NUMERO DE AVOGADRO EN LA REACCIÓN QUÍMICA GRACIAS ….
Hola Vicente. No soy Dr. jaja. Bioquímico. No entiendo tu pregunta.
Hola me puedes ayudar?…cuantos átomos hay en 1g de O, O2 y O3?
Hola. 1 g de O. Pasas ese valor a moles dividiendolo por 16. Luego multiplicas por Avogadro y listo. Para O2 hace lo mismo pero aparte hace por 2 y para O3 por 3.