En química la hibridación se refiere a la combinación de orbitales diferentes para formar otro distinto a los que le dieron orígen. Por ejemplo en la hibridación Sp3 que desarrollaremos ahora podrán ver bien el proceso. El Carbono como ya sabemos tiene número atómico 6 o sea, tiene en total 6 electrones en su átomo. Sin embargo cuando hacemos su configuración electrónica esta no explica la valencia 6 sino más bien parece que actuaría con Valencia 2 ya que son dos los electrones que quedan desapareados en el segundo y último nivel energético.
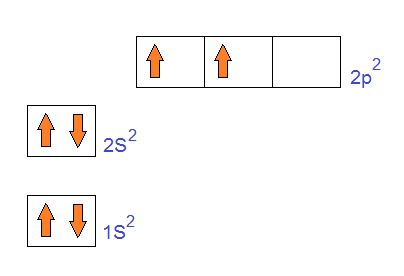
Pero esto no queda así. Uno de esos electrones del orbital 2S pasa al orbital 2p desocupado o vacío. De esta manera quedan los 3 orbitales 2p ocupados.
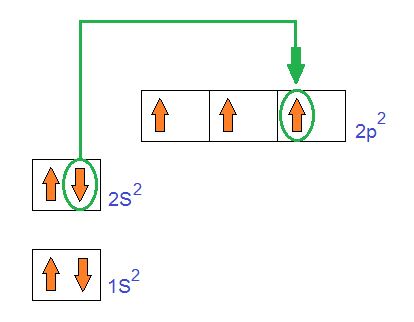
Y por último el orbital 2S que tiene un solo electrón se mezclara con los tres orbitales 2p que tienen un electrón cada uno. Formando de esta manera 4 nuevos orbitales que no serán ni S ni p. Estos serán finalmente los nuevos orbitales híbridos Sp3.
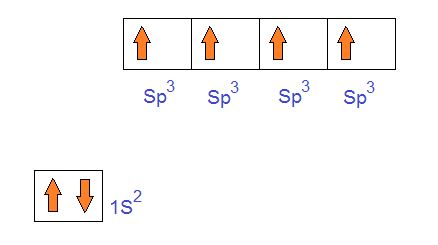
Esto explica la razón por la cual el átomo de carbono tiene cuatro valencias disponibles e iguales, es tetravalente. Y es por esto que estos cuatro orbitales Sp3 forman la figura de un tetrahedro al ubicarse con la máxima separación posible.
A continuación te dejo el siguiente tutorial para que no te queden más dudas. No te lo pierdas.
Gracias ¡¡ Bueno estoy buscando una matriz y un relleno para hacer una piesa plástica de 37mm de largo con 1.52 de espesor desde la parte superior hasta llegar al final con 4.56 y que sea rigido que no parta a 50lbs de impacto. Gracias cualquier ayuda bienvenida sea.
Hola José. ¿Que tiene que ver eso con Hibridación sp3?.
SALAMES HAY EN TODOS LADOS
Si?. Donde los viste?.
algun experimento para poder desarrollar la hibridacion
No se la respuesta
Hola buenas tarde , alguien que me ayude con la hibridacion
Características No. Orbitales que lo forman a Sp3 , Sp2 y Sp
Quisiera saber su apellido para poder citar mis trabajos, debido a que el material es bueno y conciso.
Ok Cris. Mi nombre es Patricio Andrés Arroyo. Bioquímico y Profesor.