Hola. En este artículo te voy a explicar cómo hallar los números cuánticos de cualquier electrón de un átomo. Lo vas a entender muy bien.
Acordate que los números cuánticos son cuatro. N, l, ml y ms. Número cuántico principal, Número cuántico azimutal, número cuántico magnético y número cuántico spin respectivamente. Si llegaste hasta acá es porque esto lo sabes, pero es bueno recordarlo. Cada número de estos nos da información. N nos dice en qué nivel se encuentra el electrón en cuestión que estamos analizando. El (l) nos dice en qué tipo de orbital se encuentra. El (ml) nos diferencia el orbital que ocupa cuando varios son del mismo tipo, como es el caso de los orbitales «p» o «d». No tiene sentido en el orbital «s» aunque igual debemos asignarle un número como veremos a continuación. El (ms) nos dice el sentido de giro del electrón con los valores 1/2 y -1/2. Veremos un ejemplo.
El Número atómico del Na (Sodio) es 11. O sea que tiene 11 electrones alrededor de su núcleo. Supongamos que nos piden los 4 números cuánticos del último electrón del Na. Primero es clave que hagamos la configuración electrónica con el gráfico de las cajas cuánticas. A continuación, te lo muestro en la siguiente imagen.
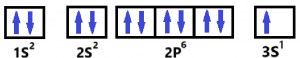
Como podrás notar, el último electrón está ocupando el último nivel (3), y el orbital (s).
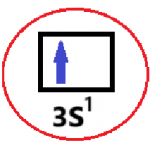
Ya que sabemos su ubicación, procedemos a colocar sus 4 números cuánticos.
Primero recordemos que valores de (l) le corresponden a cada orbital.
l = 0 (orbital «S»)
l = 1 (orbital «p»)
l = 2 (orbital «d»)
l = 3 (orbital «f»)
En el electrón que nos piden, el último, N será 3 ya que ocupa el tercer nivel. El (l) será = 0 porque al orbital «s» le corresponde el (l) = 0. El (ml) será 0 ya que los orbitales «s» se encuentran solos. Y como el electrón se lo ve con la flecha hacia arriba le corresponde el valor de spin (ms) igual a +1/2.
Ahora veremos los 4 números cuánticos del anteúltimo electrón. En esta imagen te lo marco.
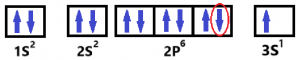
Como vemos. N es 2 ya que ocupa el nivel 2. El (l) es = 1 ya que ocupa el orbital «p». Ahora podemos ver que hay 3 orbitales del tipo «p». Uno en el centro y dos a los lados. El Número cuántico (ml) los diferencia con números. De izquierda a derecha se numeran como -1, 0 y +1. Como el anteúltimo electrón ocupa el orbital «p» de la derecha se le asigna el ml = a +1. Por último, observamos que la flecha apunta hacia abajo. así que se le asigna el -1/2 como número de spin (ms).
N = 2 l = 1 ml = +1 ms = -1/2
También es común verlos escrito de esta manera.
(2, 1, +1, -1/2)
Por último, pondremos los números cuánticos del primer electrón. Si quieres puedes dejar en tus comentarios si estás de acuerdo o no.
N = 1 l = 0 ml = 0 ms = +1/2 (1, 0, 0, +1/2)
Espero te haya servido este artículo. Ante cualquier duda deja tus comentarios. Éxitos.
Profesor: Patricio Arroyo
www.quimicayalgomas.com