Como ya sabemos, toda Sal está formada por un ion positivo (catión), que es el metal y un ion negativo (anión) que no es más que el ácido sin su hidrógeno. A su vez varía la cantidad de carga. Por ejemplo, hay cationes con una carga positiva y otros con 2 o 3 cargas positivas. Lo mismo para los aniones. Veremos a continuación como formar una sal a partir de sus iones con solo unos ejemplos que bastara, para que lo entiendas perfectamente.
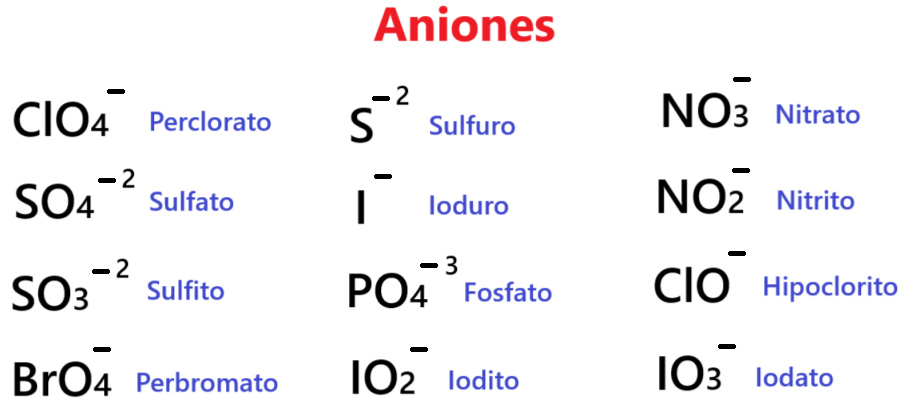
En esta imagen te muestro algunos aniones. Podemos observar la cantidad variable de cargas negativas. Algunos también tienen oxígeno y otros no- Los que tienen oxígeno provienen de oxácidos y los que no tienen provienen de los hidrácidos. Todos tienen la capacidad de formar sales.
En el caso de los cationes, estos son más sencillos ya que solo observamos al metal con su carga o cargas positivas. Como vemos en esta pequeña lista.

Nombrar los cationes es más fácil, Solo es el nombre del metal con la terminación que corresponda si tiene más de un número de oxidación. Por ejemplo Fe +3 es férrico, si hubiera sido Fe +2 es ferroso. Pero como en los casos del Na y Ca tienen una sola valencia o número de oxidación. así que no tiene terminación «oso» ni «ico».
Dicho todo esto, ahora combinaremos aniones con cationes para formar sales y todo esto te quede más que claro. Lo primero que debes tener en cuenta es que la suma de las cargas positivas y negativas debe dar cero.
Aquí formaremos el Sulfato de Sodio. Primero enfrentamos al catión sodio y al anión sulfato como vemos en la siguiente imagen. Observamos que tenemos una carga positiva y dos cargas negativas.

Para mantener la electroneutralidad, es decir que la suma de cargas de cero, debemos aumentar la carga positiva de 1 a 2. Por lo tanto, necesitamos otro catión sodio para llegar a la carga neta cero.
![]()
Ahora sí, ya logrado el objetivo tenemos la sal formada. El nombre es sencillo, lleva el nombre del anión seguido del catión. Sulfato de sodio. Las cargas las podes borrar ya que esta logrado el equilibrio de cargas.
![]()
Otro ejemplo. Anión Perclorato con catión Áurico. Aquí vemos en la imagen a los iones con sus respectivas cargas. Vemos que esta vez es el catión que tiene mas cargas positivas que el anión. Tres contra una. Necesitaremos entonces aumentar la cantidad de aniones perclorato para balancear las cargas hasta llegar a la carga neta cero.
![]()
Necesitaremos entonces aumentar la cantidad de aniones perclorato para balancear las cargas hasta llegar a la carga neta cero. Lo vemos en la siguiente imagen.
![]()
Ahora logrado el equilibrio podemos quitar las cargas y tener lista nuestra sal. Perclorato áurico.
![]()
A veces no es necesario equilibrar o balancear las cargas. Por ejemplo, si tenemos una carga de cada lado o dos de cada lado (positivas y negativas). En esta imagen observamos al anión sulfato con el catión calcio.
![]()
Como verás, no es necesario equilibrar cargas. Son dos positivas contra dos negativas.
![]()
Podes practicar más ejemplos cambiando cationes y aniones. Espero que te haya servido este post. Deja tus comentarios o dudas. Con gusto te responderé. Éxitos.
Profesor y Bioquímico: Patricio Arroyo.
www.quimicayalgomas.com